Как определить диабет первого типа за полгода до его развития

Сахарный диабет I типа – это хроническое заболевание, от которого на данный момент все еще нет лекарства. Его осложнения, среди которых первое место занимают болезни сердечно-сосудистой системы, почечная недостаточность и потеря зрения, сокращают продолжительность жизни пациентов в среднем на 11 лет.
Согласно современным представлениям, сахарный диабет I типа (СД1) является аутоиммунным заболеванием, возникающим в результате комплексного взаимодействия генетической предрасположенности и факторов внешней среды. Основой патологического процесса при нем является постепенное селективное органоспецифическое снижение числа и функции β-клеток поджелудочной железы, которые ответственны за выработку инсулина – гормона, регулирующего уровень глюкозы в крови. Когда масса разрушенных или функционально угнетенных бета-клеток достигает 80–90%, возникает инсулиновая недостаточность, приводящая к нарушению метаболизма глюкозы в организме и появлению клинических симптомов. Причина такого сбоя иммунитета и механизмы, управляющие появлением аутоантител против β-клеток, до сих пор плохо изучены.
Характерной особенностью сахарного диабета первого типа является длительная фаза бессимптомного развития – от начала возникновения аутоиммунного процесса в так называемых «островках Лангерганса», где сконцентрированы β-клетки, до клинического проявления заболевания.
Сейчас медицина выявляет болезнь на ранних стадиях, исследуя кровь пациентов на наличие аутоантител, нацеленных на антигены островков Лангерганса – т.н. «островковые аутоантитела», что позволяет нетравматично определить, нет ли аутоиммунного процесса у человека, сахар крови которого находится в пределах нормы, и принять меры по уменьшению вероятности развития будущих осложнений СД1.
Впервые островковые аутоантитела были обнаружены к антигенам цитоплазмы островков (ICA) в сыворотке периферической крови больных еще в 1974 году. В настоящее время описаны и успешно используются в клинической практике еще четыре других сывороточных аутоантитела против антигенов бета-клеток: IAA, GADA, IA‑2A и ZnT8А. Однако исследование, возглавляемое биологами из Тихоокеанской северо-западной лаборатории, под названием «Исследование экологических детерминант диабета у молодых (The Environmental Determinants of Diabetes in the Young ,TEDDY)» решило найти еще более ранние биомаркеры, предшествующие самому аутоиммунному процессу в островках.
Журнал Cell Reports Medicine опубликовал итоги этой работы1.
Протеомика плазмы при сахарном диабете и не только
Область молекулярной биологии под названием «протеомика» известна с 1997 года. Она занимается идентификацией и количественным анализом белков (при этом совокупность всех белков клетки называют протеомом). Также термином «протеомика» называют суммарно и сами методы изучения, используемые в этой области (например, масс-спектрометрия, двумерный электрофорез, секвенирование последовательности белка, вестерн-блоттинг и т.д.).
Протеомика плазмы на данный момент считается перспективной методикой для обнаружения белковых биомаркеров и применяется для идентификации биомаркеров начала сахарного диабета I типа. Для определения островковых аутоантител используются:
- радиоиммунологический анализ,
- электрохемилюминесцентный анализ и
- иммуноферментный (ELISA, ИФА) анализ.
Наиболее высокочувствительным и специфическим (но и самым дорогим) среди них считается радиоиммунологический. Хемилюминесцентный метод также довольно чувствительный, но его используют реже, так как он наиболее специфичен только при определении IAA и GADA.
Наиболее распространенный метод определения островковых аутоантител – ИФА. Он дешев, легок в использовании, но до недавнего времени считался менее чувствительным, чем радиоиммунологический анализ. Однако после создания новой его модификации – трехскринингового метода (RSR) – было установлено, что потенциально ИФА является таким же точным, как и радиоиммунологический подход.
Протеомный анализ может не только определить, есть ли у человека диабет на ранних этапах болезни, он способен дать важную информацию о механизме (или механизмах) развития этого заболевания. Для этого особенно важно определить биомаркеры, отмечающие старт каждой из стадий СД1, особенно – маркеры перехода аутоиммунной агрессии к островкам Лангерганса в клинически видимую гипергликемию.
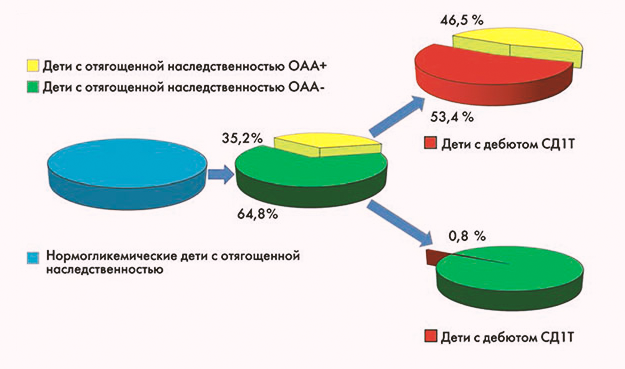
Сейчас считается, что наличие у человека (наиболее часто – у ребенка между 1 и 3 годами) четырех из указанных выше островковых аутоантител «обеспечивает» ему сахарный диабет первого типа в будущем с практически 100% вероятностью. Однако до сих пор непонятно, какие именно из известных науке антител (или их сочетания) обладают наиболее высокой диагностической ценностью для предсказания риска развития заболевания и нет ли других, более точных маркеров.
Аутоантитела к островкам
На данный момент известны следующие особенности известных медицине островковых аутоантител.
ICA – аутоантитела к антигенам цитоплазмы островков. Обнаружены в 1974 году. Определяются в сыворотке периферической крови.
IAA – аутоантитела к инсулину, обнаружены в 1983 году. Считаются наиболее специфичными, появляются в организме ребенка самыми первыми. Ряд авторов считает, что обнаружение одного IAA дает возможность предсказать развитие СД1 у детей преимущественно до 5 лет, причем величина титра этих антител и частота их выявления обратно пропорциональна возрасту ребенка. После 12 лет IAA у большинства детей не обнаруживается.
GADA – аутоантитела к декарбоксилазе глютаминовой кислоты, обнаружены в 80-х. Антиген GAD является фрагментом глютаминовой кислоты, участвует в регуляции глюкозой секреции инсулина. Он является самым широко используемым биомаркером для выявления аутоиммунной деструкции β-клеток и прогрессирования диабета на всем протяжении взросления ребенка. Сейчас считается, что для предсказания развития диабета с вероятностью более 68%, помимо определения GADA, требуется определение еще одного вида островковых аутоантител. Также считается, что риск развития диабета связан с титром GADA: при низком титре СД1 развивается у 11% обследуемых, а при высоком титре – у 45%.
IA‑2A – аутоантитела к протеину‑2-тирозин-фосфатазы / антигена‑2 инсулиномы. Считаются одним из главных маркеров аутоиммунного разрушения β-клеток, обладают высокой специфичностью. Часто используются как биомаркер выявления асимптомной фазы СД1. Вероятность развития СД1 при одновременном появлении GADA и IA‑2A – более 70%. Также полагают, что IA‑2A связаны с риском прогрессирования дисгликемии (потеря толерантности к глюкозе, снижение продукции С-пептида, повышение уровня HbA1с).
ZnT8A – аутоантитела к транспортеру ZnT8A, обнаружены в 2008 году. Один из наиболее достоверных и специфических маркеров предсказания возникновения СД1, находится преимущественно в островках. Определение ZnT8A совместно с GADA и IA‑2A предсказывает развитие диабета в вероятностью выше 90%. Считается, что обнаружение повышенного титра ZnT8A указывает на тенденцию быстрого прогрессирования болезни.
В целом риски возникновения клинически видимого сахарного диабета I типа можно изобразить на следующей инфографике.
Исследование TEDDY
Как уже можно было понять из предыдущего раздела, практически за 40 лет изучения медицина смогла выделить только пять биомаркеров – и те до сих пор не привязала к конкретным проявлениям сахарного диабета первого типа. Это связано с тем, что разработка биомаркеров – длительный процесс, к тому же, многие исследования терпят неудачу из-за отсутствия систематической проверки кандидатов.
Биологи из Тихоокеанской северо-западной лаборатории пошли другим путем – они решили в дополнение к традиционным методам исследования задействовать в вычленении биомаркеров искусственный интеллект.
Исследование типа «случай-контроль» было проведено на основании разбивки участников на 8 групп (в зависимости от наличия или отсутствия сероконверсии, развития полноценного диабета или «застревания» в фазе аутоиммунной агрессии к островкам Лангерганса к возрасту 6 лет, а также контроля для каждого типа групп), которым в два этапа определяли биомаркеры в плазме крови.
На первом этапе ученые провели глубокий протеомный анализ образцов плазмы от ограниченного числа участников. На втором – искали, не обнаружатся ли (а если да – то какие, в каком количестве и в какой период времени) отобранные потенциально перспективные биомаркеры у остальных участников исследования.
В общей сложности на первом этапе было проведено 1488 масс-спектрометрических анализов материала. Суммарно было идентифицировано 36 252 пептида, полученных из 1720 белков, из которых для финальных исследований ученые отобрали 376 значимых белков. До конца исследования дошли в общей сложности 694 пептида из 167 белков.
В качестве помощи для понимания места определенных биомаркеров в развитии сахарного диабета ученые использовали машинное обучение. Искусственный интеллект определил корреляции наличия каждого белка в определенный период времени с процессами, приводящими к манифестации заболевания.
Оказалось, что как фазу аутоагрессии против островков Лангерганса, так и сам сахарный диабет у детей до 6 лет можно прогнозировать с высокой точностью за 6 месяцев до возникновения сероконверсии. Ученые выявили пептидов 127 пептидов из 83 белков, которые участвуют во всех процессах при развитии диабета – это белки, задействованные в презентации антигена, компоненты систем комплемента и свертывания крови, белки внеклеточного матрикса, сигнальные белки, которые передают сигналы воспаления, и метаболические белки.
Особенно «активными» оказались в этом плане белки системы комплемента (каскадная система протеолитических ферментов, предназначенная для гуморальной защиты организма от действия чужеродных агентов, участвует в реализации иммунного ответа организма) и свертывания крови.
Так, полиморфизм белков системы комплемента был связан с более высоким риском развития СД1. Повышенная активация и отложение этих компонентов были обнаружены в поджелудочной железе у лиц с развившимся диабетом. Пациенты с СД1 также продемонстрировали повышенное свертывание крови, в том числе усиление агрегации тромбоцитов и коагуляционной активности, а также снижение фибринолиза. Комплемент также может участвовать в опсонизации (процессе адсорбции опсонинов на поверхности микроорганизмов и других инородных частиц, который стимулирует и облегчает фагоцитоз данных частиц) патогенов или мертвых клеток, вероятно, β-клеток, в сторону фагоцитоза.
Также, вероятно, в процессах манифестации диабета участвуют и компоненты систем, участвующих в фагоцитозе, а также лизосом. Они задействованы в разрушении патогенов и мертвых клеток, но также принимают участие и в презентации антигена. Более высокие уровни протеасом (многобелковый комплекс, разрушающий ненужные или дефектные белки при помощи протеолиза до коротких пептидов) приводят к аномальной презентации антигена и развитию аутоиммунной реакции.
Полиморфизм гена презентации антигена HLA действительно является основным фактором риска развития СД1, потому что разные варианты HLA могут по-разному представлять аутоантигены островков. Во время фазы аутоагрессии к островкам вырабатываются провоспалительные цитокины и хемокины, запускающие апоптоз β-клеток и помогающие рекрутировать лейкоциты, что приводит к инфильтрации ими островков поджелудочной железы (инсулиту). Эта передача сигналов также приводит к регуляции экспрессии генов и клеточного метаболизма, что наблюдали ученые.
Исследование показало, что изменения, касающиеся метаболических белов, наблюдаются задолго до сероконверсии и могут служить биомаркерами раннего предсказания диабета. Также аномальное соотношение проинсулина и С-пептида может быть обнаружено за 12 месяцев до начала СД1, что свидетельствует о дисфункции в обработке инсулина, которая может повлиять на метаболизм организма еще до того, как возникнет гипергликемия.
Нарушается и метаболизм желчных кислот. Было, например, выявлено, что триацилглицерины, которые являются основными компонентами липопротеинов плазмы, ниже у детей, у которых развился диабет, по сравнению с детьми, у которых была аутоагрессивная фаза без колебаний сахара крови. Субъединицы липопротеинов, такие как Аро CIII, оказались связаны с развитием СД1. Было показано, что Аро CIII запускает апоптоз β-клеток.
Проведенное исследование имеет целый ряд ограничений – главным их которых является достоверность машинных моделей анализа, – но, тем не менее, оно определяет и сужает вектор поиска потенциальных биомаркеров для каждой стадии развития сахарного диабета I типа. Таким образом, в настоящее время у медиков, помимо использования определения островковых аутоантител с целями диагностики асимптомной доклинической стадии и предсказания возникновения диабета, оценки количества сохранных островков Лангерганса при уже развившемся начальном СД1 и более точной дифференциации взрослого диабета I типа от диабета II типа, появляются перспективы раннего вмешательства в течение сахарного диабета I типа с возможным его полным предотвращением.