Холод против боли

В конце 2022 года в журнале «SCIENCE» были опубликованы результаты1 исследования нового медицинского устройства – микроимпланта для подавления болевых ощущений. Идея основывалась на древнем, «прабабкином» методе лечения – прикладывании мешочка со льдом к больному месту. Группе ученых под руководством Джонатана Ридера удалось пройти еще дальше – и обеспечить полную блокаду нерва.
Однако дадим им слово.
Травма и имплантируемые устройства
После травмы мы часто нуждаемся в адекватном обезболивании. Традиционные методы – таблетки и инъекции НПВП и стероидов, снимающие воспаление и отек, – часто не дают желаемого эффекта, человек прибегает к опиоидам... и в результате медики сталкиваются с тем, что у них под наблюдением оказывается большое число наркотически зависимых людей, как это произошло в случае Америки, «проглядевшей» последствия расширения показаний к применению этой группы препаратов.
Здоровую альтернативу опиоидам современная медицина усматривает в имплантируемых устройствах, способных целенаправленно и обратимо блокировать активность периферических нервов. Всем известный «прабабкин способ» – прикладывание пакетика со льдом на место ушиба – может служить простым примером того, что с болью можно бороться и другим, гораздо более физиологическим способом.
Миниатюрные имплантируемые устройства, которые устраняют болевые сигналы в периферических нервах «на местах», позволяют избежать побочных эффектов, связанных с опиоидами и другими анальгетиками. Контролируемый ввод электрических, фармакологических, оптических, механических или термических раздражителей в нервную ткань может привести к локальной и обратимой нейрональной блокаде.
Принадлежащее к этой группе методов местное охлаждение представляет собой привлекательный способ устранения болевых сигналов по требованию, но имеющиеся на данный момент технологии неудобны для пациента, не могут доставить холод непосредственно в болящее место, и, кроме того, требуют повторной операции по изъятию устройства. В противовес этому группа американских ученых предложила небольшие, мягкие, саморастворяющиеся со временем устройства, которые позволяют доставлять охлаждение в любую точку организма с минимальным повреждением и контролировать процесс. Многонедельные испытания на животных моделях показали, что подобные имплантаты быстро и точно охлаждают периферические нервы для обеспечения местной анальгезии по требованию при нейропатической боли.
Почему холод?
Известно, что показатели метаболической, электрогенной и ионной активности в нервной ткани демонстрируют отрицательную температурную зависимость с течением времени. Локальное охлаждение периферических нервов снижает скорость проводимости и амплитуду сигнала нейронной активности. Блокировка передачи сложных потенциалов действия в нервах млекопитающих обычно происходит при температуре ниже 15°C, но этот порог можно временно повысить почти до комнатной температуры с помощью короткого периода нагрева, предшествующего периоду охлаждения. Охлаждение, применяемое к периферическим нервам, является многообещающим подходом для блокировки болевых сигналов, поскольку оно не вызывает привыкания, обратимо, может применяться локально и позволяет одновременно проводить электрическое исследование заблокированного нерва.
Недостатком метода на данный момент было то, что он требовал точного пространственно-временного контроля температуры, потому что охлаждение также может и повредить ткани, а сами устройства были громоздкими, неудобными и не позволяли использовать локальное охлаждение периферических нервов на практике.
Группа ученых под руководством Джонатана Ридера, разработавшая новое устройство для местного охлаждения нервов, видит его применение в довольно специфической нише. Их имплантируемое устройство, обеспечивающее местную аналгезию по требованию в течение определенного периода времени с последующим растворением и биорезорбцией, планируется использовать для лечения послеоперационных сигналов острой боли в периферических нервах, где:
- аберрантные нервные сигналы четко определены в выбранных анатомических областях;
- нервы, несущие аберрантные нервные сигналы, уже изолированы;
- существует необходимость для опиоидной терапии после операции.
Такое совпадение условий, когда соответствующие нервы уже изолированы и идентифицированы и применение устройства будет легко интегрироваться в клинический рабочий процесс, характерно, например, для состояний после ампутаций, трансплантации нервов или операций по декомпрессии позвоночника.
На рисунке ниже показано, как установка вокруг нерва физиологически распадающегося со временем импланта-охладителя позволяет обратимо устранить нервную активность и болевые сигналы посредством локальной доставки холода. Конструкция из водорастворимых материалов естественным образом приводит к растворению системы охлаждения после завершения процесса заживления и устраняет необходимость в хирургической операции по извлечению.
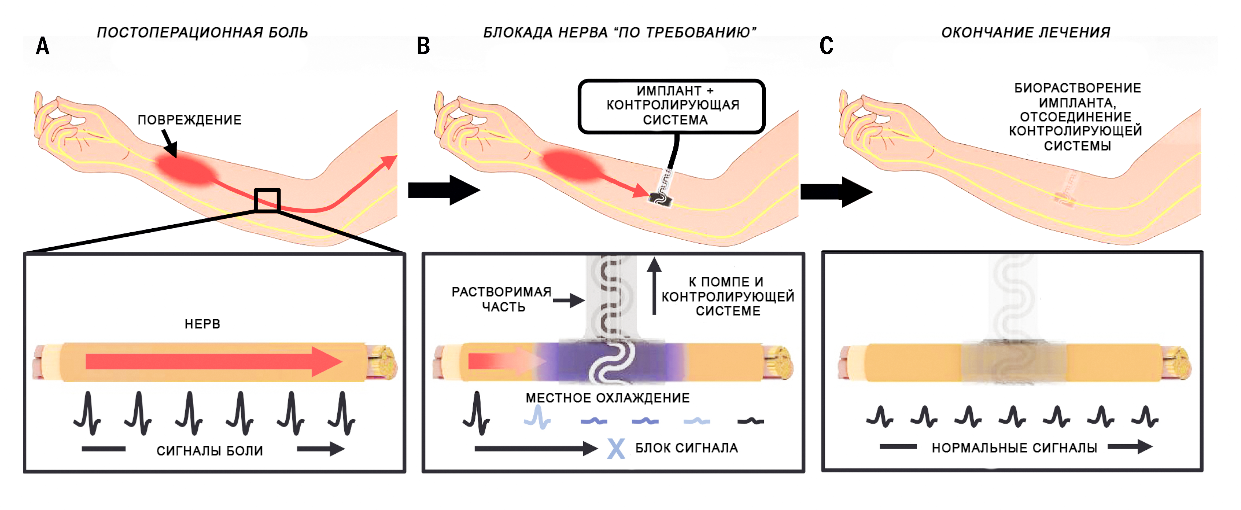
Имплант Ридера
Имплантат, который придумали американские ученые, представляет собой гибрид микрофлюидной (микрожидкостной) и электронной систем для охлаждения и одновременного измерения температуры периферического нерва. Эластомерная природа микрофлюидной системы и змеевидная форма электрических соединений обеспечивают мягкое, эластичное растяжение, схожее с упругостью естественных нервов. Устройство заканчивается манжетой, диаметр которой соответствует диаметру седалищного нерва крысы (1,5 мм), что обеспечивает тесный механический и тепловой контакт с нервом без необходимости наложения швов. Изогнутость манжеты и ее эластичность позволяют вручную разворачивать ее и мягко сжимать нерв.
Важной определяющей характеристикой этой системы является то, что она полностью состоит из водорастворимых материалов, которые контролируемо растворяются до физиологических конечных продуктов в биожидкостях, содержащихся в подкожной клетчатке.
На рисунке показан распад импланта, обернутого вокруг силиконового фантомного нерва и погруженного в фосфатно-солевой буфер с pH 7,4 при температуре 75°C в качестве теста на ускоренное старение. Результаты показывают, что материалы в основном растворяются в течение 20 дней, а удаление остатков происходит через 50 дней.
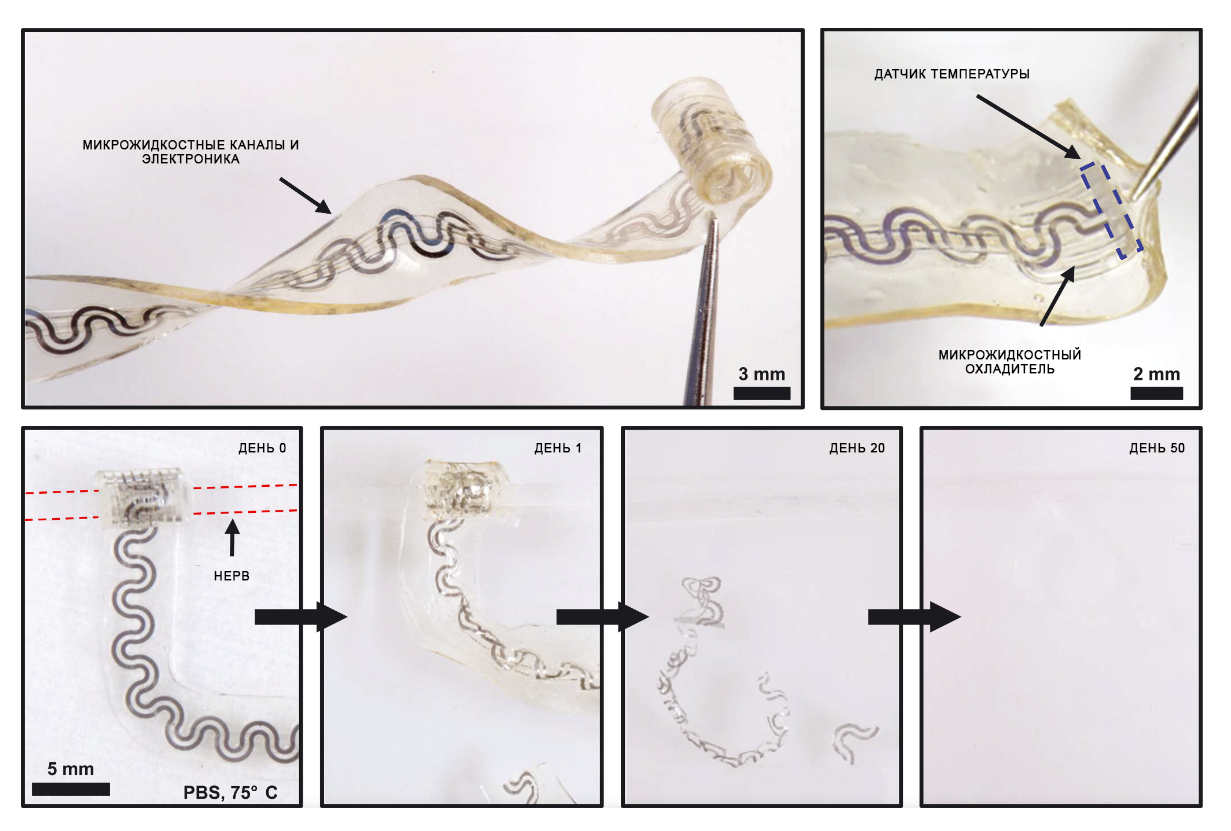
Микрофлюидная составляющая имплантата представлена биорезорбируемым эластомером полиоктандиолцитратом POC (полиоксиалканоаты, ПОА – это биоразлагаемые полиэфиры оксикарбоновых кислот, которые получают как путем химического, так и с помощью бактериального синтеза) и включает в себя чрескожные колинеарные соединения, которые доставляют жидкий хладагент перфторпентан и сухой азот в змеевидную испарительную камеру в полностью герметичной системе, обеспечивающей доступ жидкости на концах.
Электронный слой расположен копланарно с микрофлюидной системой, при этом термочувствительный элемент находится на дистальном конце устройства. Одновременное инициирование потоков перфторпентана (который кипит при комнатной температуре, биоинертен и совместим с нефторированными эластомерами, а также широко и давно используется в медицине – например в ингаляторах, как контрастное вещество для внутривенного ультразвукового исследования и при терапевтической гипотермии) и азота в эту структуру вызывает испарение перфторпентана.
Молярные соотношения потоков перфторпентана и азота и форма испарительной камеры определяют величину и локализацию охлаждающего эффекта. При низких молярных соотношениях потоков перфторпентан полностью испаряется после прохождения через три змеевика с незначительным накоплением жидкости перфторпентана в углах микроканалов.
При высоких молярных скоростях потока перфторпентан протекает по кольцевому потоку и проходит вдоль боковых стенок микроканалов. Это фазовое изменение приводит к тому, что температура устройства в плоской, развернутой конфигурации падает до -20°C в течение 2 минут после инициализации потока в условиях комнатной температуры. Охлаждаемая область устройства преимущественно ограничена змеевидной испарительной камерой, что определяется конструкцией микрожидкостного канала и скоростью потока жидкости. Змеевидная магниевая дорожка обеспечивает температурную обратную связь через температурный коэффициент сопротивления магния.
Конденсатор, расположенный дистальнее охлаждающей манжеты, позволяет улавливать 90% испаренного перфторпентана. Доставка азота в режиме, управляемом давлением, смягчает переходные скачки давления, которые могут возникнуть при многофазных микрожидкостных потоках.
В лабораторных условиях такой имплантат показал возможность обеспечения точного и локального охлаждение нерва в течение 21 дня. Эксперименты показывают устойчивое и последовательное охлаждение нерва до 3,0°C в течение 15 минут.
Опыты на животных моделях
Подведение холода в конкретное место без необходимости использования изолирующих слоев представляет собой ключевую особенность разработанного командой американских ученых импланта-охладителя.
Испытания на крысах показывают, что такое устройство способно обратимо устранять вызванные острой травмой нервные сигналы и не создавать дополнительного повреждения нерва.
Так, например, электромиография передней большеберцовой мышцы показывает снижение амплитуды потенциалов на 92% и увеличение латентности сигнала нервно-мышечной активности на 64% при охлаждении от 31°С до 5°С в течение 8 минут. После же согревания в течение 3 минут амплитуда и латентность возвращаются, соответственно, к 108% и 100% от исходных значений.
Также эксперименты проводились и на модели нейропатической боли, связанной с повреждением сохраненного нерва, у крыс. Такая модель позволяет оценить возможности микрофлюидных имплантов-охладителей блокировать боль у свободно движущихся животных. Оказалось, что охлаждение седалищного нерва до 10°C при помощи импланта увеличивает механический ноцицептивный порог в семь раз, что указывает на значительный обезболивающий эффект, который оказывает холод. При этом гистологическое исследование тканей, прилегающих к импланту, через 1, 2, 3 месяца и полгода указывают на непосредственную близость манжеты к нерву и свидетельствуют как о биосовместимости, так и об успешном самораспаде устройства.
Таким образом, первично доказана эффективность и безопасность подобных методов в применении не только у лежачих, но и ведущих активный образ жизни пациентов. Проведенные американцами исследования закладывают инженерную основу для нового класса имплантатов, способных целенаправленно блокировать нейроны, в том числе – и для локального обезболивания «по требованию», и могущих, наконец, потеснить опиоиды на медицинском рынке.




