Брадикинин, ангиотензин и сомнительный повод курить коноплю

Человечество болеет COVID-19 уже без малого год – но ни внятного понимания механизма поражения такого большого количества органов и систем, ни специфического (то есть направленного на возбудитель) лечения до сих пор нет. Противовирусные препараты, которые фактически «переделаны» для борьбы с коронавирусной болезнью из старых заготовок, показывают неутешительные результаты, а новые вакцины, несмотря на то, что большая часть из них уже проходит последние тестирования, не вызывают энтузиазма ученых – вполне возможно, что иммунитет, который они создадут, будет держаться не более полугода. И самое неприятное – существующие подходы симптоматического, то есть поддерживающего организм до того времени, пока вирус его не покинет, лечения также оставляют желать лучшего.
Именно сочетание этих трех факторов заставляет исследователей усиленно искать пути к пониманию вируса SARS-CoV-2. Однако, кажется, здесь нам уже улыбнулась удача – буквально на днях суперкомпьютер Summit из Национальной лаборатории Ок-Ридж в Теннесси, считающийся вторым по быстродействию в мире, обработал1 данные о более чем 40 000 генов из 17 000 генетических образцов пациентов с COVID-19 и подтвердил2 возникшую в конце весны теорию о брадикининовой природе повреждений при COVID-19.
О том, что это даст нам и почему это серьезный шаг для спасения миллионов жизней – читайте ниже.
Раз – и РААС
COVID-19 с самого начала поставил научное общество в тупик – и отнюдь не количеством и разнообразием вызываемых им повреждений (в конце концов, две предыдущие эпидемии родственных коронавирусов позволяли ожидать тяжелого течения заболевания), а тем, что те не поддавались «нормальному» лечению по отработанным на целой когорте болезней алгоритмам и были, мягко говоря, странными.
«Тихая» гипоксия – когда человек до самого последнего момента не чувствовал, что у него поражены легкие, и падал замертво на улице, как мы увидели это в Китае.
Неэффективность аппаратов искусственной вентиляции легких – палочке-выручалочке всех тяжелых состояний.
Внезапная польза от стероидов, по поводу которых научное общество уже почти пришло к окончательному выводу, что они ухудшают течение вирусных заболеваний.
И, конечно же, потеря обоняния и осязания, «ковидные пальцы», инсульты и инфаркты у молодых и Кавасаки-подобный миокардит у детей.
Как выяснилось, крошечный, неспособный даже к независимому размножению РНК-вирус, который цепляется к вроде бы ответственным только за регулировку давления белкам, поражал в итоге всё – от почек до головного мозга. Странно?
Но если мы более внимательно посмотрим на систему, к которой принадлежат эти белки, и их другие функции, кроме регулировки артериального давления, странным это уже не покажется.
Итак, РААC, ренин-ангиотензин-альдостероновая система, к которой принадлежат те самые известные нам по публикациям в медиа белки АСЕ2 (ангиотензинпревращающий фермент 2, АПФ2), служащие мишенью для вируса SARS-CoV-2, хорошо известна как механизм коррекции кровообращения, который восстанавливает артериальное давление и объем циркулирующей крови в случае кровотечения или обезвоживания.
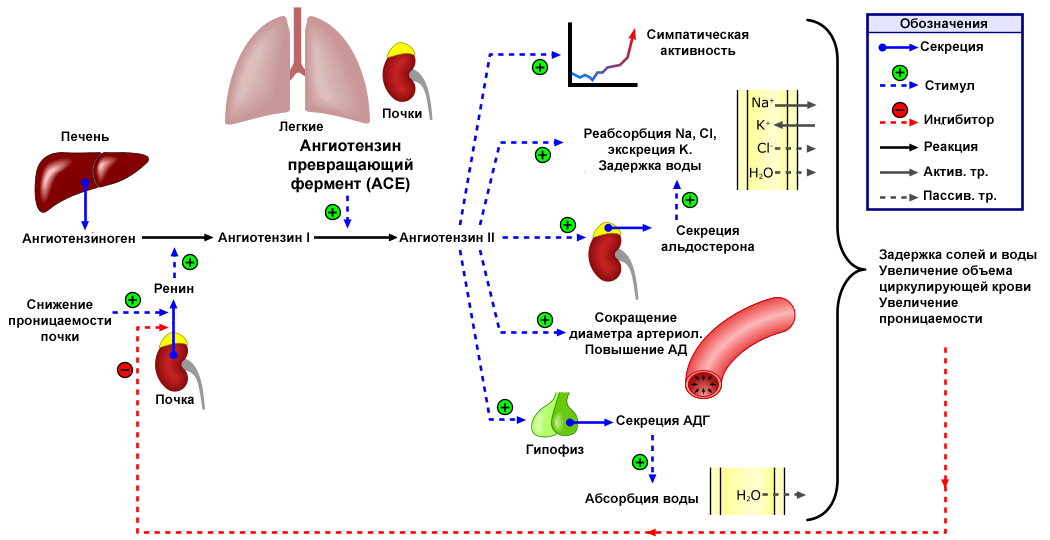
Источник: wikimedia.org.
Изменение давления и солевого баланса на уровне почек усиливают или ослабляют секрецию ими первой из «букв» нашей аббревиатуры – гормона ренина, который, в свою очередь, начинает управлять превращением второй «буквы», ангиотензина, предшественник которого производится печенью. В этом процессе им помогает ангиотензинпревращающий фермент (на английском angiotensin converting enzyme, ACE), который поставляют уже легкие. Получившийся в итоге ангиотензин 2 активно сужает сосуды, изменяет секрецию гормона альдостерона (управляющего выведением/задержкой воды и солей) и регулирует всю систему. Лекарства под названием ингибиторы АПФ влияют на ангиотензинпревращающий фермент, давление у людей с артериальной гипертензией падает. Лекарства из группы блокаторов ангиотензина 2 влияют, соответственно, на ангиотензин 2 и тоже понижают давление.
Так вся эта схема выглядела для большинства врачей в докоронавирусную эпоху. Конечно, все знали, что процесс не идет исключительно линейно и образующиеся промежуточные продукты обладают способностью превращаться дальше по разным путям с разными эффектами, но это никого особо не волновало.
Первые ласточки появились при эпидемии SARS в начале нулевых, когда оказалось, что тяжелейшее повреждение органов и тканей вызывает способность вируса связываться с еще одной, в норме представленной в незначительном количестве, формой ангиотензинпревращающего фермента – АСЕ2 (АПФ2), который, в отличие от обычного АСЕ, давление снижает, обладает кардиозащитными свойствами и вообще «ведет себя хорошо».
Также пришлось вспомнить, что РААC является регулятором и множества других, помимо давления, функций, касающихся буквально всех систем организма: метаболизма глюкозы, работы сердца, сосудов и нервной ткани, восприятия кислородного голодания, протекания воспалительной реакции, свертываемости крови и многого другого. Эволюция сделала РААC главным регулятором, который при тяжелой травме координирует все органы и системы, чтобы сохранить главное – гомеостаз.
Да и в самом каскаде превращений ангиотензиногена (печеночного предшественника ангиотензина) в ангиотензин 2 оказалось много интересного.
Ось АСЕ
Каскад преобразований предшественника ангиотензина ангиотензиногена, называемый еще «осью AПФ» или «осью АСЕ», приводит нас к связыванию ангиотензином 2 его специфического рецептора AT1, в результате чего и реализуются все эффекты, включая сохранение натрия в почках, коагуляцию, воспаление, развитие фиброза и гибель клеток. Но в организме всегда работает не только АПФ, но и АПФ2 (далее мы будем пользоваться латинским обозначением ферментов – АСЕ и АСЕ2, потому что именно эти названия мы привыкли видеть во всех медиа с начала 2020 года), который оказывает противоположное воздействие, самих ангиотензинов имеется целое семейство, да рецептор к ним не один. Таким образом удерживается некий баланс.
Так, например, если ангиотензин 2 связывается с рецептором АТ1 (в английском варианте прочтения AGTR1), он сужает сосуды и задерживает натрий, а если с АТ2 – расширяет сосуды и выводит натрий с мочой2.
Также, помимо ангиотензина 2, в систему РААС входят (и оказывают свое действие) и другие ангиотензины, из которых ученые особенно выделяют ангиотензин Ang1-7 (который связывается с рецептором MAS1, вызывая противовоспалительное и сосудорасширяющее действие) и ангиотензин Ang1-9, который связывается с рецептором АТ2 («полезным»). Ангиотензин Ang1-7 получается совместными усилиями ферментов ACE и ACE2, а Ang1-9 – одного только ACE23.
Выглядит это приблизительно так.
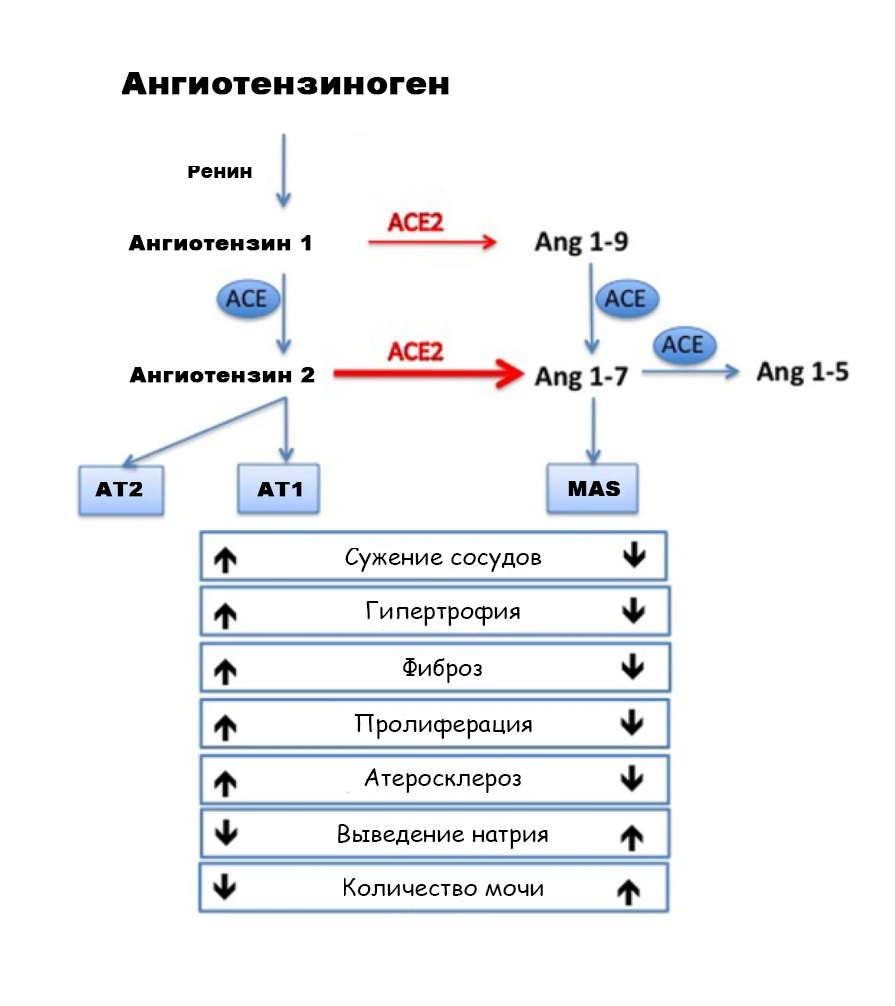
АСЕ-атака коронавирусов
При заражении коронавирусами SARS и SARS-CoV-2 из оси АСЕ «выпадает» АСЕ2, потому что оба вируса используют его для своих целей. SARS-CoV-2 проникает внутрь клетки, связываясь с ACE2 на ее поверхности, а потом «въезжая» на нем вовнутрь, как на знаменитом Троянском коне. А поскольку ACE2 экспрессируется не только в легких, но и в сердце, почках, кишечнике, кровеносных сосудах и даже половых органах, SARS-CoV-2 может также инфицировать практически все что угодно4.
Попав в клетку, вирус останавливает производство ACE2. Кроме того, SARS-CoV-2 неравномерно (АТ1 в 430 раз, а АТ2 – в 177 раз) активирует рецепторы к ангиотензину, чем окончательно рушит весь баланс сил.
Избыточное производство ангиотензина 2 при помощи ACE усиливает свертывание крови, что приводит к образованию тромбов и, соответственно месту, в котором они образуются, инсультов и инфарктов. По той же самой причине выходят из-под контроля воспаление и фиброз, повреждается ткань почек, возникают миокардиты и нарушения ритма сердца, а отключение регулирующих уровень глюкозы рецепторов инсулина сопровождается симптомами диабета.
Также выброшенный в огромном количестве ангиотензин 2 нарушает регуляцию клеточного объема и вызывает масштабную гибель клеток, чем можно объяснить неспособность каротидного тела регистрировать снижение уровня кислорода в крови (та самая не ощущаемая до критического поражения легких гипоксия). Гибнут и нейроны, отвечающие за обоняние.
Самый главный наш регулятор на случай непредвиденный ситуаций – РАААС – выходит из строя. Дублирующей ее системы у человека нет.
С этим же поражением РААС связаны и отличия, которые фиксируются учеными с самого начала эпидемии. Так, достоверно хуже COVID-19 протекает у лиц, заболевания которых приводят к дисбалансу в этой системе в виде повышенной активности ACE и сниженной или неадекватной ей активности ACE2. Это гипертоники, диабетики, курильщики табака (ниже мы объясним, к чему здесь это, казалось бы, очевидное уточнение), лица с лишним весом, часть раковых больных, мужчины5 и просто пожилые люди.
Это не означает, что дисбаланс РААС является единственным фактором, ответственным за тяжесть течения COVID-19 у этих людей. Например, диабетики, раковые больные, пожилые люди и люди с ожирением имеют «в багаже» дефицит питательных веществ и иммунные нарушения. Также плохо едят и тяжелее болеют слои населения, стоящие в низу социальной лестницы. Им, вдобавок, еще и хуже оказывается помощь – среди простых рабочих, например, сложно найти человека, имеющего возможность купить себе курс тоцилизумаба.
Иммунитет мужчин5слабее, чем иммунитет женщин, также среди них больше курильщиков, что тоже связано и с иммунными нарушениями, и с повреждением ткани легких – основной «фабрики» АСЕ2.
Моча в голову
Но не все эффекты COVID-19 можно объяснить одним воздействием сошедших с ума ангиотензиновых качелей. РААС ответственна за еще один регулятор нашего организма – кининовую (вернее, калликреин-кининовую) систему6.
Калликреин-кининовая система – это не просто группа белков крови, анекдотически найденная при попытке ввести мочу внутривенно7, это целый каскад, занимающийся регуляцией сосудистого тонуса, мочевыведения, воспаления, коагуляции и ощущения боли, и одна из ключевых систем крови, которая вместе с РААС поддерживает баланс артериального давления, антигенной совместимости и гемостаза. Фактически, это ключевой гормональный путь, противодействующий8 сверхактивности РААС. Из-за тесной связи с РААС некоторые авторы9 даже предлагали считать калликреин-кининовую систему частью РААС.
Самым главным компонентом калликреин-кининовой системы является полипептид брадикинин. Помимо свойств снижать давление, он обладает мощным сосудорасширяющим эффектом, индуцирует продукцию простагландинов (белков, участвующих в воспалении) и увеличивает проницаемость сосудов, что приводит к просачиванию жидкости за их пределы.
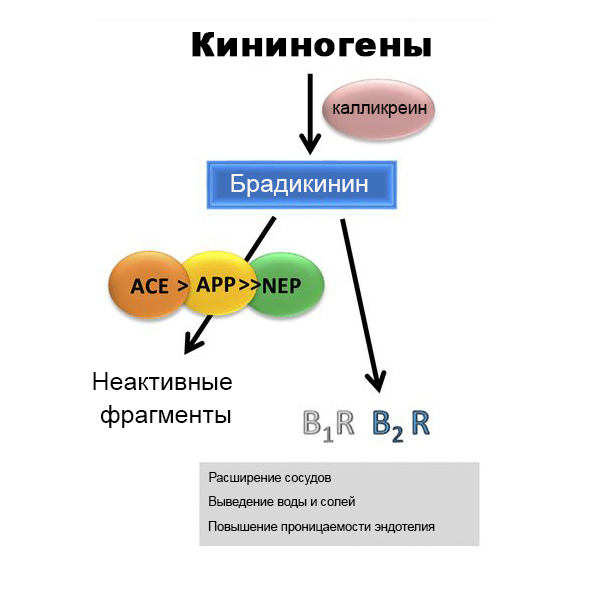
Фермент, «делающий» его из кининогена, калликреин, тоже имеет «подработку» – он участвует в процессах свертывания крови.
Кстати, надо сказать, что каскад превращений, дающий нам брадикинин из кининогена, управляется, в частности, и цинком, который инактивирует калликреин. А калликреин, в свою очередь, очень «любят» вирусы, например, грипп.
Соответственно, идея лечить10 (или, по крайней мере, облегчать) приемом добавок или препаратов цинка ОРЗ или даже COVID-19 берет начало именно в попытке выключить им избыточное образование повреждающего сосуды и ткани брадикинина.
Осуществляется действие брадикинина через два рецептора – B1R и B2R, причем если на B2R действует сам брадикинин, то на B1R действует его «огрызок» desArg9-брадикинин (DABK).
За сосудорасширяющее действие (а также за выведение солей и падение давления) отвечает преимущественно B2R, который находится в большинстве тканей нашего организма и в изобилии присутствует в клетках сосудистой выстилки. B1R же экспрессируется в здоровой ткани минимально, но индуцируется ее повреждением и потом активно участвует в формировании хронической боли и воспаления.
Для того чтобы брадикинин не оказывал такого патологического действия, в дело включаются ферменты РААС – уже известные нам АСЕ и АСЕ2. Первый, вместе с рядом менее активных пептидаз типа аминопептидазы P (APP), NEP, эндотелин-превращающего фермента (ECE)-1 и других, расщепляет брадикинин на неактивные фрагменты. Именно поэтому лечение ингибиторами этого фермента (ингибиторы АПФ) приводит к значительному увеличению уровней брадикинина, усиливая их сосудорасширяющее и антигипертензивное действие.
Однако «усиление» брадикинина – это палка о двух концах: хотя мощные сосудорасширяющие эффекты ингибиторов АПФ можно отчасти объяснить повышенным уровнем брадикинина, с ним же связаны и побочные эффекты этих препаратов – в частности кашель.
А вот DABK расщепляет второй фермент, АСЕ2.
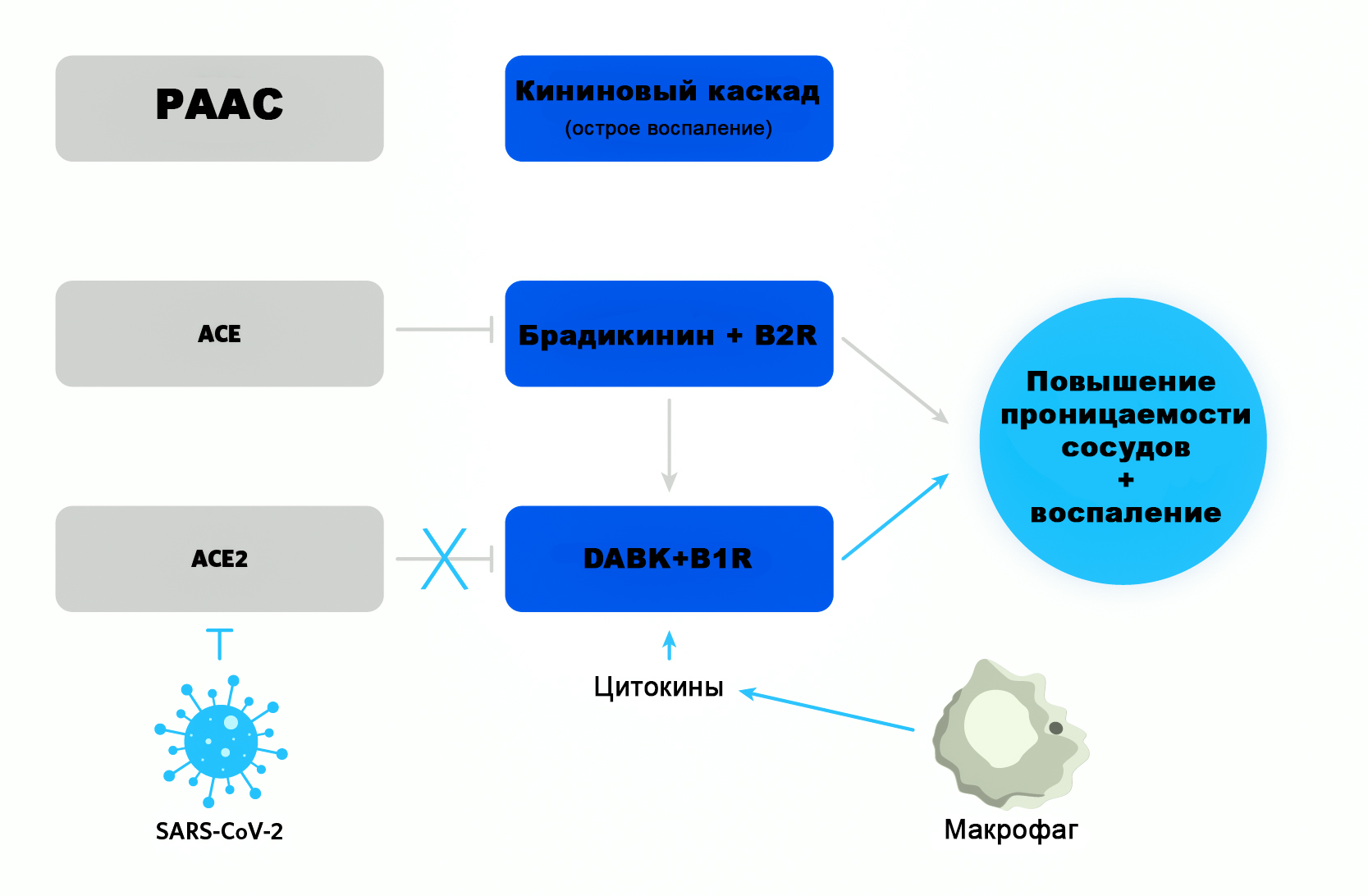
Как можно понять, ACE и ACE2 действуют как регуляторные тормоза в калликреин-кининовой системе. Но поскольку коронавирусы SARS и SARS-CoV-2 захватывают АСЕ2 для своих целей, брадикининовый каскад превращений остается без одного из «контролеров», сосуды начинают пропускать жидкость и клетки воспаления в ткани, развивается отек и воспаление. Кроме того, при поражении вирусами активированные клетки иммунной защиты под названием макрофаги секретируют специальные провоспалительные белки цитокины, такие как интерлейкин-1 и фактор некроза опухоли альфа, которые, в свою очередь, тоже стимулируют B1R и, соответственно, воспаление11.
Участвуют РААС и калликреин-кининовая система и в обмене гиалуроновой кислоты, которая заполняет альвеолы легких при COVID-19, мешая дышать через аппараты ИВЛ, и вызывает его характернейший рентгенологический признак «мутного стекла». Оказывается, ангиотензин 2 увеличивает активность фермента гиалуронидазы, а продукция цитокина под названием интерлейкин-2 (который увеличивает проницаемость сосудистой стенки в том числе и для гиалуроната) в значительной мере связана с брадикинином12.
Что это значит для нас?
И какой с этого толк мне, спросит читатель.
Самый непосредственный. В отличие от антивирусных препаратов, которые для SARS-CoV-2 еще не созданы (что бы там не пыталась изобразить РФ из старого японского фавипиравира), лекарства, тормозящие брадикинин, и даже еще более сложная группа – искусственные АСЕ2, уже давно есть в распоряжении медиков.
Препараты, «выключающие» половую систему (даназол), анаболический стероид станозолол, которым лечат ангионевротический отек, и ингибитор калликреина экалантид снижают выработку брадикинина и потому становятся вероятными кандидатами на проведение исследований подавления брадикининового шторма при COVID-19.
Завершилось исследование, где изучали терапию рекомбинантным АСЕ213, которое показало отличные результаты.
Орфанный препарат (то есть лекарство от редчайших болезней) икатибант, блокатор брадикининовых B2-рецепторов, противоаллергический препарат, который применяется для симптоматической терапии острых приступов наследственного ангионевротического отека у взрослых с дефицитом ингибитора C1-эстеразы, снижает передачу сигналов брадикинина и может ослабить его эффекты, когда выброс уже произошел.
Можно даже не ходить далеко – давно известно, например, свойство витамина D подавлять РААС на тканевом уровне. Если учитывать, что недостаточность этого витамина чаще наблюдается у лиц негроидной расы и пожилых людей (группы риска для COVID-19), вполне возможно, что коррекция его уровней у этой категории может повысить выживаемость и облегчить течение болезни.
И самое смешное – полезной14 может оказаться даже такая вредная привычка, как... курение конопли!
Дело в том, что ряд исследований связывают эндоканнабиноидную систему с системой РААС, включая перекрестное взаимодействие между уровнями каннабиноидного рецептора 1 и ангиотензина 2. Вполне возможно, что каннабис, помимо снижения давления (которое опосредуется через блокаду АСЕ), может блокировать и другие эффекты разбушевавшейся РААС.
Так это или нет, мы узнаем, вероятно, в самом ближайшем будущем. Но пока что ясно одно – у нас уже есть фармакологические инструменты для подавления гиперактивности оси ACE и мы должны попытаться использовать их.
Примечания
- 1. Has the Summit Supercomputer Cracked COVID’s Code?
- 2. a. b. Michael R Garvin и другие. A mechanistic model and therapeutic interventions for COVID-19 involving a RAS-mediated bradykinin storm
- 3. LB Arendse и другие. Novel therapeutic approaches targeting the Renin-Angiotensin system and associated peptides in hypertension and heart failure
- 4. Reza Khodarahmi и другие. The ACE2 as a “rescue protein” or “suspect enzyme” in COVID-19: possible application of the “engineered inactive hrsACE2” as a safer therapeutic agent in the treatment of SARS-CoV-2 infection
- 5. a. b. Differences in immune responses create a genetic conflict between sexes
- 6. Lauren B. Arendse и другие. Novel Therapeutic Approaches Targeting the Renin-Angiotensin System and Associated Peptides in Hypertension and Heart Failure
- 7. A Dendorfer, S Wolfrum, P Dominiak. Pharmacology and cardiovascular implications of the kinin-kallikrein system
- 8. Alberto Sainz-Cort и другие. The interaction between the endocannabinoid system and the renin angiotensin system and its potential implication for COVID-19 infection
- 9. Alvin H. Schmaier .The plasma kallikrein-kinin system counterbalances the renin-angiotensin system
- 10. M Kalinska и другие. Kallikreins - The melting pot of activity and function
- 11. Alakananda Dasgupta. Is a Bradykinin Storm Brewing in COVID-19?
- 12. COVID-19 coagulopathy: an evolving story
- 13. Alexander Zoufaly и другие. Human recombinant soluble ACE2 in severe COVID-19
- 14. Alberto Sainz-Cort & Joost H. Heeroma. The interaction between the endocannabinoid system and the renin angiotensin system and its potential implication for COVID-19 infection




