Третья смена зубов

Потеря зубов из-за врожденных или приобретенных заболеваний или несчастных случаев является распространенной проблемой среди всех слоев населения, но особенно характерна для стариков. Современные подходы к терапии подобного состояния включают в себя зубные имплантаты, мосты и зубные протезы. Для устранения незначительных дефектов часто ограничиваются винирами, люминирами и так далее; единичные коронки ставят, если удается сохранить разрушенный зуб; зубные мосты – когда потерянные зубы находятся в разных местах. При полной адентии (то есть отсутствии зуба) возможна как установка съемных протезов, так и постоянных протезов на имплантатах.
Однако все это не заменяет полностью своего родного, настоящего, живого зуба. Мысль о регенерации зубов не нова, и уже давно витает в воздухе. За последнее десятилетие интеграция медицины с химией и передовой инженерией предоставила публике альтернативу старым подходам.
Так, например, разрабатываются несколько регенеративных методов, включая регенерацию тканей на основе каркасов, клеточную и тканевую инженерию, активацию третьего поколения зубов и регенерацию зубов с редактированием генов в животных моделях, чтобы повысить шансы на регенерацию утраченных зубов1.
Но особенно перспективным направлением оказалась регенерация зубов путем активации третьего поколения зубов2.
Как меняются зубы
Сменой зубов называется замена одного поколения зубов другим. Если происходит только одна смена зубов, использую термин дифиодонтизм или дифиодонтия (два поколения), если больше – полифиодонтизм.
В норме зубы будущего ребенка – как молочные, так и постоянные коренные – закладываются в его организме еще во время пребывания в утробе матери. После рождения прорезываются молочные, вырастают, а в 6-8 лет начинают меняться на коренные.
Эта смена зубов обусловлена изменением размера челюсти с взрослением человека. У взрослого размер челюсти больше – и коренные зубы, соответственно, крупнее. Также с возрастом в зубах происходит перестройка зубной ткани – молочные зубы отличаются от постоянных меньшей плотностью и невысокой минерализацией тканей.
К старости коренные зубы обычно критически поражаются кариесом или выпадают из-за болезней десен. Однако у людей, доживших до 90+ лет, иногда наблюдается рост третьего поколения зубов.
Происходит это потому, что в организме человека имеются специфический генный механизм, позволяющий запустить повторный рост зубов. Однако за миллионы лет эволюции млекопитающих эти гены у большинства людей стали спящими и запустить их снова можно лишь эволюционно или искусственно.
Восстановление зубов с помощью стволовых клеток
Еще один вариант, рассматриваемый современной медициной – возможность вырастить зубы из стволовых клеток. Этот метод уже пытались использовать в лечении такой стоматологической патологии, как периапикальные поражения, возникающие в результате некроза пульпы зуба, заболевания десен и пульпит. Большинство исследований дали неплохие результаты без каких-либо вредных последствий, что позволило сделать вывод о том, что использование стволовых клеток действительно безопасно для пациентов. В 2010 году группа ученых из Колумбийского университета даже сумела вырастить целый зуб всего за 9 недель, а в 2014 году исследователи из Гарварда использовали лазер для активации стволовых клеток и регенерации роста зубов у мышей3.
Однако у этого метода есть ряд ограничений.
Главным из них является совместимость. Если донор не подходит хозяину, иммунная система будет атаковать новые клетки.
Вторым – то, что до сих пор выращивать зубы удавалось лишь у животных, а, несмотря на то, что процесс роста дентина у животных и людей схож, это не точное соответствие, поэтому хотя исследователям и удалось физически регенерировать зуб у животного, для воспроизведения этого процесса у людей необходимо внести ряд изменений, которые пока что не разработаны.
Также не так давно стволовыми клетками пытались вылечить поражение пульпы. Для этого мобилизованные стволовые клетки пульпы зуба (MDPSC) имплантировали в поврежденные или травмированные зубы, после чего наблюдалась регенерация значительной части ткани пульпы, включая кровеносные сосуды и нервы4.
Еще одно исследование на эту тему выявило несколько ключевых маркеров, необходимых для регенерации ткани пульпы зуба5.
Однако этот метод пока еще находится в стадии разработки, поэтому основное внимание медиков приковано к методике «пробуждения генов», находящейся на последнем этапе клинических испытаний.
Проблема анодонтии
Открытие, легшее в основу новой осакской методики пробуждения зубов третьей генерации, напрямую связано с исследованиями так называемой «анодонтии» – то врожденного есть полного или частичного отсутствия зубов. Это заболевание встречается примерно у 1% населения. Основной причиной того, что у одной десятой части пациентов с анодонтией отсутствует шесть или более зубов (т.н. «олигодонтия») считаются генетические факторы. Эти состояния также известны как агенезия зубов. Исследования девяностых-нулевых начали идентифицировать гены, удаление которых приводило к тому, что у генетически модифицированных мышей вырастало меньше зубов.
Такахаси Кацу был одним из тех ученых, которые заинтересовались этой проблемой. Получив диплом стоматолога, в 1991 он году поступил в аспирантуру по молекулярной биологии в Киотском университете, а после переехал учиться в США, где и познакомился с темой генного регулирования анодонтии6.
После возвращения в Японию, он продолжил свои изыскания и в конце 2000-х, работая в Киотском университете, обнаружил, что у мышей, у которых отсутствовал определенный ген, было увеличено количество зубов. Это состояние стало результатом активной роли мезенхимальных клеток, которые в случае нормальной работы гена были бы потеряны из-за апоптоза. Белок, синтезируемый дефектным геном и ограничивающий рост зубов, назвали USAG-17.
Далее, работая все с той же группой своих коллег, он открыл, что в появлении дополнительных зубов у мышей с дефицитом USAG-1 играют значительную роль сигнальные пути BMP и WNT. Развитие зубов находится под контролем как генов-партнеров, так и интерактивной сигнализации между эпителием полости рта и краниальной мезенхимой. В течение следующих пяти лет исследователи закрепили свой успех, обнаружив, в частности, взаимодействия и роль USAG-1 и других генов-партнеров, таких как гены BMP7 и Runx 2, в развитии зубов.
Сосредоточение внимания на поиске новых причин врожденного отсутствия зубов у японских пациентов привело к открытию вариантов WNT10A , которые играют решающую роль в развитии боковых резцов, которые более чувствительны к сигналам WNT и β-катенина от других зубов, и другим важным научным прорывам.
В конце концов исследовательская группа Такахаси сосредоточилась на USAG-1 и разработала нейтрализующее антитело, способное блокировать функцию этого белка. В экспериментах 2018 года мышам с врожденно малым количеством зубов давали лекарство, которое приводило к прорастанию новых зубов. Результаты исследования были опубликованы в рецензируемом издании «Science Advances» в 2021 году и привлекли большое внимание как начало первой в мире терапии по регенерации зубов8.
Этим лекарством было антитело и siRNA против USAG-1.
Малые интерферирующие РНК или siRNA (Small interfering RNA) – это небольшие антисмысловые РНК длиной около 20–25 нуклеотидов. Они генерируются из двухцепочечных РНК и играют важную роль в путях интерференции РНК путем посттранскрипционной регуляции экспрессии генов. Эти регуляторы самообновления в стволовых клетках являются частью сложной и взаимосвязанной транскрипционной сети. По этой причине потеря функции одного регулятора может, в некоторых случаях, компенсироваться путем корректировки уровней экспрессии других компонентов сети.
Интерферирующие РНК (RNAi), siRNA и микроРНК (miRNA) недавно были применены в генной терапии рака. siRNA подавляют экспрессию канцерогенных генов, воздействуя на информационную РНК (мРНК). siRNA вызывает подавление генов, образуя комплексы индуцированного РНК-сайленсинга (RISC) и расщепляя целевые молекулы мРНК. Для терапии рака siRNA функционируют путем ингибирования сверхэкспрессии целевой мРНК в раковых клетках. Малая интерферирующая РНК также может использоваться с противораковыми средствами для преодоления лекарственной устойчивости, что является существенной проблемой для терапевтически эффективного применения противораковых препаратов.
Такахаси, который изучает не только анодонтию, но и гипердонтию, считает, что у людей имеется закладка не двух, а трех «наборов» зубов, и третий набор представлен спящими «почками». Так, например, в каждом третьем случае гипердонтии рост дополнительных зубов является следствием существования именно этого, третьего поколения зубов.
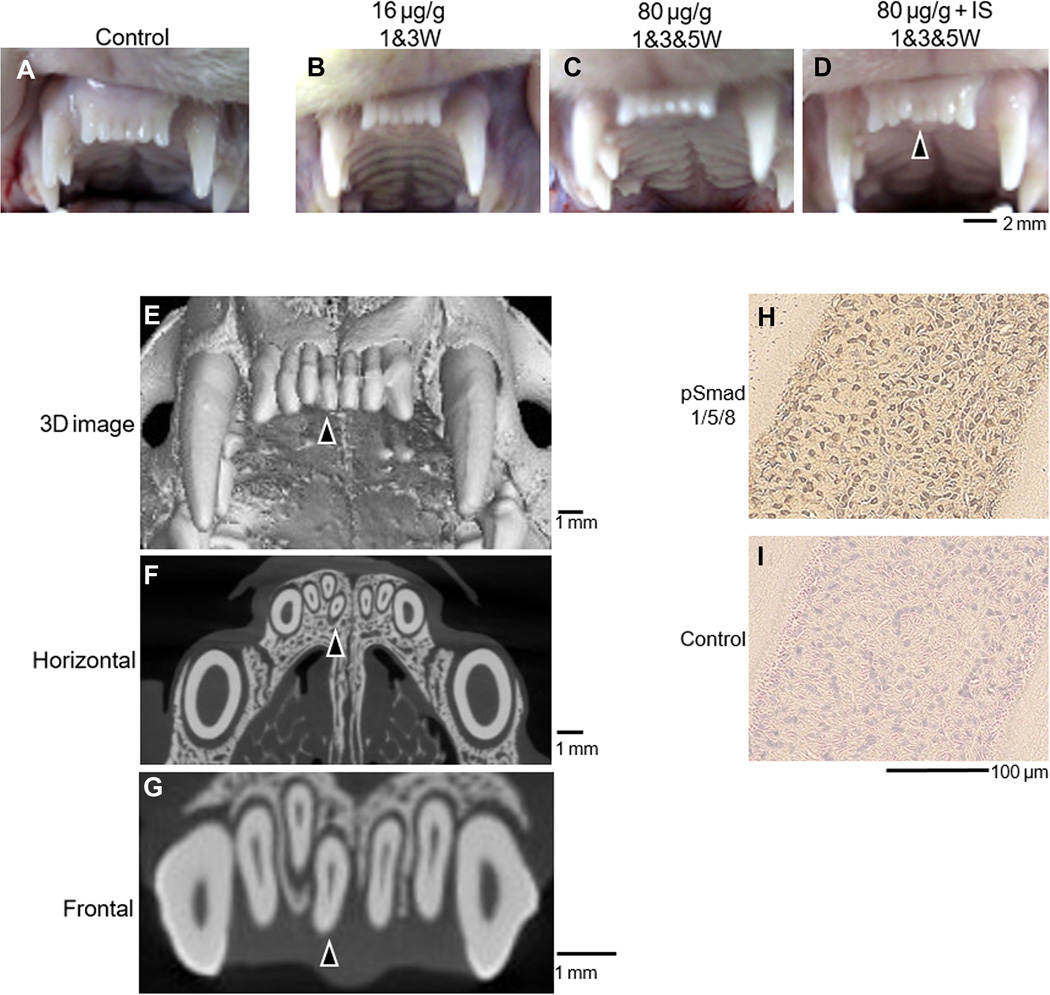
Доказательством служат и эксперименты Такахаси на животных: когда его группа применила свой экспериментальный препарат для пробуждения роста зубов на основе siRNA, дополнительный седьмой передний зуб вырос между существующими передними зубами и имел ту же форму.
Когда же у людей?
После более чем десятилетних экспериментов по исследованию механизмов управления процессом возникновения третьего поколения зубов у животных, группа Такахаси наконец перешла к изучению пробуждения роста зубов у людей.
Для начала было проведена компьютерная томография, призванная оценить роль закладки зубов третьей генерации в формировании т.н. «сверхкомплектных» зубов. Ученые пришли к выводу, что третье поколение зубов действительно обеспечивает образование сверхкомплектных зубов, при этом эффект наиболее выражен у лиц мужского пола.
В статье 2023 года, опубликованной в «Regenerative Therapy», Такахаси пишет, что его группа проверяет эффективность лечения антителом USAG-1 в других моделях агенезии зубов у млекопитающих, прежде чем начать клиническое исследование фазы 1. Он указывает, что зубы растут благодаря взаимодействию между эпителиальными и мезенхимальными клетками и что в норме количество зубов у всех видов обычно определяется и эволюционно сохраняется на основе формы и функции зубов в зубном ряду. Однако нокаут белка USAG-1 позволяет рудиментарным резцам выживать и расти как сверхкомплектные зубы, что и было показано его группой на животной модели. Это дает возможность предполагать, что пробуждение «третьей генерации» зубов у людей позволит вырастить из них новые зубы в дополнение к уже существующим.
Также Такахаси отмечает, что в регуляции роста и развития зубов участвуют около 200 генов, включаясь на разных стадиях этого процесса, и отбор тех из них, что помогают пробудить спящую закладку третьей генерации, поможет создать новое лекарство для восстановления утраченных зубов. Это лекарство особенно перспективно, потому что рост зубов запускается естественным образом, посредством процесса, известного как передача сигналов костного морфогенетического белка (BMP), то есть тело выполняет само, без какой-либо сложной инженерии стволовых клеток.
В октябре этого года команда Такахаси, который параллельно заведует отделением хирургии полости рта в Медицинском исследовательском институте больницы Китано в Осаке, начала клинические испытания в больнице Киотского университета, вводя взрослым антитело, блокирующее USAG-19.
Это исследования предназначены главным образом для проверки безопасности препарата, а не его эффективности, и являются первым шагом к тому, чтобы перепрофилировать препарат для лечения анодонтии у детей от 2 до 6 лет, так как в Японии этим наследственным заболеванием в тяжелой форме, ограничивающей функцию жевания и сопровождающейся серьезными косметическими дефектами, страдают около 0,1% людей. Такахаси надеется, что на медицинские рынки его антитело выйдет уже в 2030 году.
Западные ученые, которые ознакомились с исследованиями японцев, относятся к ним очень с большой надеждой, так как препарат на основе антител, воздействующий на белок, почти идентичный USAG-1, уже используется для лечения остеопороза.
Примечания
- 1. Tissue regeneration and reprogramming
- 2. Advances in tooth agenesis and tooth regeneration
- 3. Columbia University announces break-through in tooth regeneration
- 4. Deciduous autologous tooth stem cells regenerate dental pulp after implantation into injured teeth
- 5. Regeneration of pulpo-dentinal-like complex by a group of unique multipotent CD24a+ stem cells
- 6. World's 1st 'tooth regrowth' medicine moves toward clinical trials in Japan
- 7. Rudiment incisors survive and erupt as supernumerary teeth as a result of USAG-1 abrogation
- 8. Anti–USAG-1 therapy for tooth regeneration through enhanced BMP signaling
- 9. Clinical Trials For Drug That Replaces Missing Teeth Finally Underway




