Сахарный диабет I типа обратим?
В январе 2024 года в журнале «Nature» вышла без преувеличения сенсационная статья, рассказывающая об успехе фармакологического эксперимента – впервые в мире ученые смогли заставить клетки протоков поджелудочной железы превратиться в клетки, вырабатывающие инсулин в ответ на нагрузку глюкозой1. Для сотен миллионов диабетиков, страдающих сахарным диабетом I типа (далее мы будем также употреблять сокращение «СД1»), появилась надежда избавиться от инъекций и, наконец, получить возможность по-настоящему вернуться к нормальной жизни.
Ниже мы поделимся с читателями главными тезисами этой статьи и расскажем, как ученым удалось добиться такого невероятного прорыва.
Как возникает сахарный диабет I типа
Диабет – одно из самых распространенных заболеваний в мире. Им страдают около 400 миллионов человек, и практически 10% смертности от всех причин приходится тоже на него. В основе диабета I типа лежит ошибочное разрушение иммунной системой человека β-клеток – эндокринных клеток островков поджелудочной железы, которые синтезируют, хранят и высвобождают инсулин. Разрушение этих клеток приводит к потере способности правильно регулировать уровень глюкозы в крови и пожизненной зависимости от введения инсулина. И хотя современные лекарства помогают контролировать уровень сахара, они не предотвращают, не замедляют и не обращают вспять снижение количества β-клеток, секретирующих инсулин. Поджелудочная железа остается функционально «мертвой».
Такой «сбой системы» возникает в самом начале жизни человека (в отличие от сахарного диабета второго типа), и уже в детстве подобные пациенты становятся инвалидами, зависящими от уколов инсулина.
Современные подходы к лечению сахарного диабета I типа
Современные методы лечения СД1 направлены на восстановление массы β-клеток у людей с диабетом. К ним относятся, в первую очередь, трансплантация всей поджелудочной железы или островков. Хотя эти подходы продемонстрировали клиническую эффективность, они сопряжены с рядом серьезных проблем: нехваткой доноров и побочными эффектами иммунодепрессантов, которые необходимо принимать пациентам после трансплантации (так, например, требуется примерно 3 донорских поджелудочных железы для создания достаточного количества эквивалентов островков для трансплантации одному реципиенту). Поэтому неудивительно, что существует острая необходимость в поиске новых методов лечения, которые бы стимулировали рост и восстанавливали функцию β-клеток.
Перспективной «целью» в этом случае служат клетки-предшественники, находящиеся в протоках поджелудочной железы. Исследования, проведенные ранее и касавшиеся особенностей генеза островков Лангерганса, заставили ученых предположить, что β-клетки произошли от клеток-предшественников внутри протоков поджелудочной железы. Экспериментальные модели, при которых протоки перевязывались или часть поджелудочной железы вырезалась, подтвердили эту теорию: клетки эпителияпротоков превращались в островковые эндокринные клетки при экспрессии NGN3, что отражает эмбриональное развитие.
Однако когда ученые попытались отследить клоны, они не нашли взрослые β-клетки, которые бы возникли из клеток протоков, и решили, что более верной является теория саморепликации β-клеток, которые поддерживают так постоянство клеток во взрослой популяции.
С тех пор было получено множество экспериментальных доказательств как в пользу первой, так и второй теории. Самые последние исследования по этой теме показали, что протоковые NGN3+ клетки могут дифференцироваться во взрослые β-клетки, и это согласуется с исследованиями секвенирования РНК.
Эксперимент 2023 года
В 2022 году вышло исследование, которое доказало, что путем преобразования рефрактерной природы хроматина с помощью вещества GSK126 (ингибитора фермента метилтрансферазы EZH2) возможно частично восстановить экспрессию гена инсулина в клетках протоков поджелудочной железы, но все же у ученых оставались определенные сомнения, можно ли значимо подавить EZH2 и достаточно ли снижения H3K27me3 для восстановления экспрессии генов, чтобы повлиять на экспрессию белка in situ2
В рамках продолжения эксперимента исследовательская группа из Австралии взяла клеточную культуру поджелудочной железы, полученную от ребенка, умершего от впервые обнаруженного СД1, взрослого с длительно протекавшим СД1 и здорового взрослого без диабета, и исследовала влияние низкомолекулярного ингибитора GSK126 на регенеративную способность β-клеток. Кроме того, дополнительно после этого ученые протестили на культуре этих же клеток и таземетостат, другой селективно-конкурентный ингибитор EZH2, который с 2020 года используется для лечения саркомы у взрослых и подростков. Целью эксперимента было охарактеризовать влияние этих низкомолекулярных ингибиторов на регенеративную способность поджелудочной железы. Результаты были ошеломляющими.
Так, секвенирование РНК клеток, стимулированных GSK126 и таземетостатом, выявило повышенную экспрессию генов ISL1, NEUROD1, PTF1A и FGF10 в клеточной культуре, полученной от ребенка с СД1, что свидетельствует о скоординированном новообразовании и созревании β-клеток. Более того, FGF10 помогает сохранить панкреатический пул клеток-предшественников, а ISL1, NEUROD1 и PTF1A способствуют дифференцировке и созреванию β-клеток. Наблюдаемое увеличение экспрессии INS, как считают ученые, может быть результатом повышенной активности транскрипционных факторов, которые влияют на дифференцировку и созревание инсулинпродуцирующих β-клеток.
Эти выводы требуют, однако, определенного подтверждения в последующих экспериментах, так как в текущее исследование попало небольшое количество экспериментального материала, плюс необходимо поверить, будет ли такое фармакологическое ингибирование EZH2 достаточно эффективным, если у человека все еще сохраняется определенная остаточная активность β-клеток.
Роль хроматина и другие открытия
Австралийским ученым удалось показать эпигенетически опосредованную стратегию перепрограммирования терминально дифференцированных клеток протоков поджелудочной железы взрослого человека в инсулин-продуцирующие β-подобные клетки путем специфического воздействия на подавление по умолчанию, опосредованного метилтрансферазой EZH2. Хотя эта метилтрансфераза способен связывать транскрипционный фактор NGN3, также известно, что она влияет на судьбу продуцирующих гормоны NGN3+ клеток поджелудочной железы.
Также ученые обнаружили, что способность реактивировать транскрипционную активность ключевых регенеративных генов путем ингибирования EZH2 в эпителиальных клетках протоков поджелудочной железы человека находит свое отражение в модификации хроматина и снижении H3K27me3. В то время как бивалентность защищает обратимо репрессированные гены от дефолтного подавления экспрессии генов, ингибирование EZH2 эффективно повышает H3K4me3, тем самым влияя на регенеративную способность. Например, донорские и протоковые эпителиальные клети, подвергшихся воздействию GSK126 и таземетостата, эффективно восстановили экспрессию рецептора GPR119, что согласуется с его ролью в глюкозозависимой секреции инсулина в поджелудочной железе.
Также ученые наблюдали мощную экспрессию гена IAPP, что соответствует усилению секреции инсулина. Такое повышение позволяет предположить, что клетки протоков поджелудочной железы могут приобретать свойства, подобные свойствам β- клеток.
В пользу этого также свидетельствует и повышенная экспрессия PTF1A, что указывает на клеточную дифференцировку, плюс снижение экспрессии ингибитора инсулина ADRA2C.
Ученые предполагают, что EZH2-опосредствованный механизм участвует в изменении фенотипа клеток протоков и секреции инсулина.
Механизм превращений можно представить в виде рисунка.
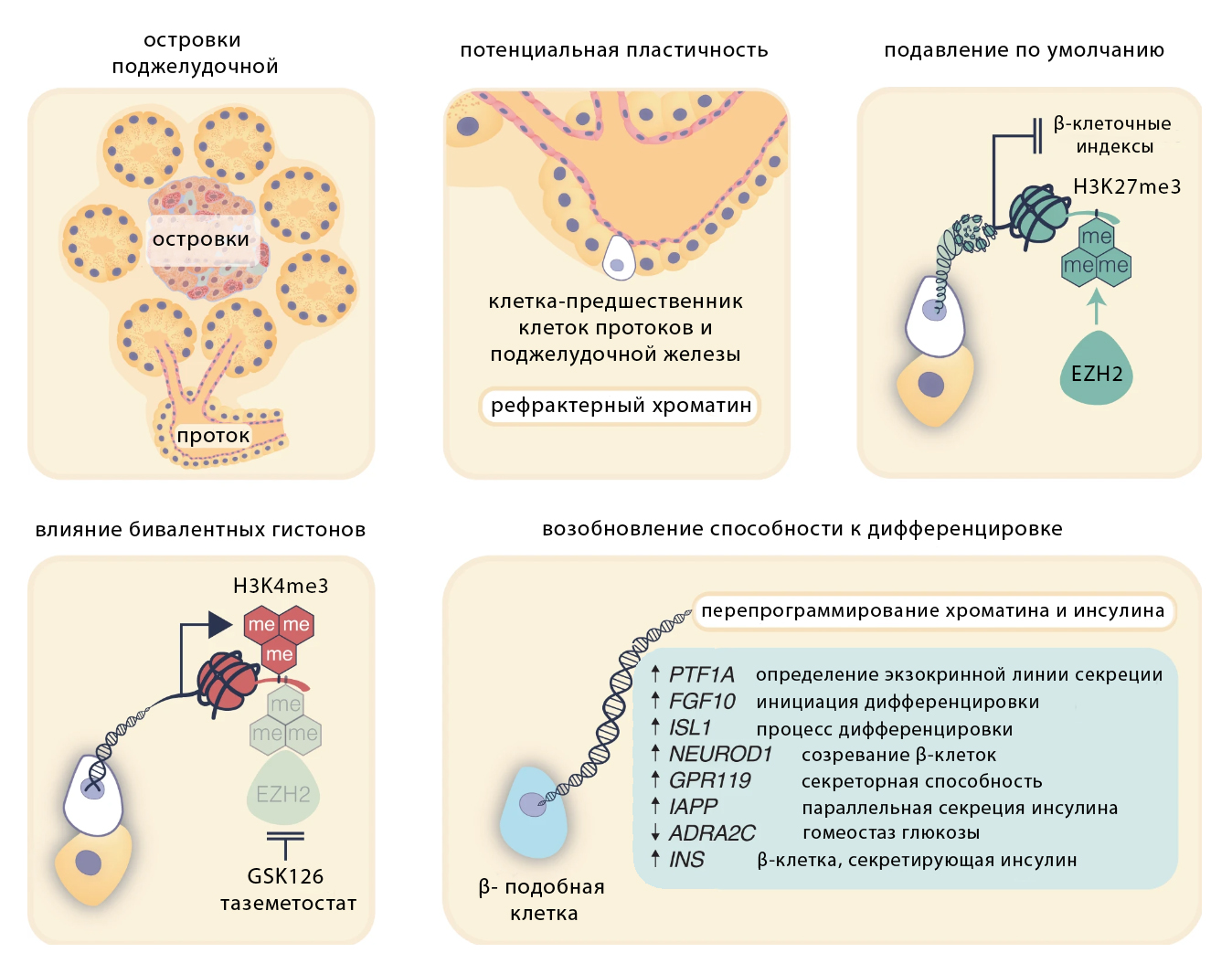
Фармакологическое ингибирование EZH2 катализирует активацию предшественников поджелудочной железы и созревание β-клеток. На схеме показано развитие от мультипотентных клеток-предшественников поджелудочной железы до зрелых инсулин-секретирующих β-клеток. Клетки-предшественники поддерживаются в мультипотентном состоянии. Снижение уровней H3K27me3 смещает бивалентную метку H3K4me3 на этих предшественниках в сторону эндокринной линии, отмеченной активацией PTF1A , и подготавливает эти клетки к дифференцировке. В то время как передача сигналов FGF10 стабилизирует это состояние клеток-предшественников, ISL1 и NEUROD1 влияют на эндокринную активность, которая поддерживает созревание β-клеток. Повышение регуляции GPR119 и IAPP, наряду с подавлением ADRA2C, ослабляет ингибирующие сигналы, способствуя стимулируемой глюкозой секреции инсулина.
Также интересно, что стимуляция клеток протоков поджелудочной железы с помощью GSK126 и таземетостата может влиять на экспрессию гена INS и коррелирует с экспрессией типичных маркеров β-клеток PDX1 и MAFA, а PDX1 в нормальном состоянии, хотя активно участвует в развитии поджелудочной железы, во взрослом возрасте влияет лишь на зрелые β-клетки, отвечая за поддержание выработки инсулина. Кроме того, оказалось, что таземетостат может восстанавливать экспрессию INS, чем влияет на хроматин и подавление транскрипции.
Хотя GSK126 и таземетостат являются конкурентными ингибиторами EZH2, их влияние на экспрессию генов было различным, но сопоставимым. Пока что не ясно, влияет ли на этот процесс выбор схемы дозирования препаратов. Ученые считают, что их данных достаточно, чтобы сделать вывод о том, что метилтрансфераза EZH2 ограничивает экзокринную регенеративную способность человека, в то время как ингибирование этого фермента предлагает возможную стратегию влияния на регенерацию без влияния на жизнеспособность клеток.
Выводы
При СД1 наиболее прямым механизмом репрессии транскрипции, независимым от последовательности ДНК, является метилирование гистонов. Смерть инсулинозависимого ребенка, которого лечили постоянными инъекциями в течение почти четырех лет, является очередным напоминанием о доминирующей роли подавления по умолчанию и подчеркивает его влияние на регенеративный барьер.
Австралийские ученые полагают, что неспособность реактивировать транскрипцию ответственна за подавление показателей функциональной активности β-клеток и вполне вероятно, что воздействие на резистентный хроматин может влиять на способность к регенерации. Такое «пробуждение» спящих клеток и преодоление воздействия хроматина может быть достигнуто в резистентных экзокринных клетках путем ингибирования зависимых от EZH2 процессов подавления экспрессии генов (сайленсинга).
Таким образом, клетки-предшественники протоков поджелудочной железы являются многообещающим источником для регенерации β-клеток при СД1 благодаря присущей им способности к дифференцировке, а стимуляция экзокринных клеток ингибиторами EZH2 GSK126 и таземетостатом однозначно влияет на фенотипический сдвиг в сторону идентичности β-подобных клеток. Переход от «спящего» к «пробужденному» состоянию зависит от модификации двухвалентного хроматина H3K27me3 и H3K4me3.
Ученые считают, что выбор EZH2 в качестве мишени для лекарств обеспечит регенерацию функции β-клеток, так как «перепрограммированные» клетки протоков поджелудочной железы продемонстрировали в эксперименте выработку инсулина в ответ на физиологическую нагрузку глюкозой. Весьма вероятно, что именно низкомолекулярные ингибиторы EZH2 лягут в основу будущих лекарств от СД1.