Резистентность к витамину D как возможная причина аутоиммунных заболеваний – финские открытия
В предыдущей статье «Резистентность к витамину D как возможная причина аутоиммунных заболеваний»1 мы рассмотрели общие предпосылки вероятной связи аутоиммунных заболеваний и приобретенной резистентности к витамину D, в частности – нарушенный баланс управления обратной связью «витамин D/паратиреоидный гормон», в этой – более подробно коснемся молекулярных и генетических механизмов управления системой преобразований витамина D.
Статья основывается на результатах систематического обзора, проведенного группой немецких ученых в 2021 году2.
Гипотеза 1-2-1
В предыдущей статье мы упомянули два исследования финских ученых, которые обнаружили, что умеренно высокие дозы витамина D вызывают неодинаковый ответ в популяции, разделяя ее на 3 части в пропорции 1–2–1 таким образом, что приблизительно 1/4 часть всех людей имеет низкий уровень ответа на терапию, 2/4 – средний, и еще 1/4 – высокий. Они предположили, что резистентность может возникнуть, если воздействовать на систему витамина D в нескольких местах.
На рисунке синими молниями выделены места, где на метаболизм витамина D могут влиять однонуклеотидные полиморфизмы (SNP). Синий текст – дополнительные факторы, создающие основу для развития приобретенной резистентности к витамину D путем нарушения передачи сигналов в системе витамина.
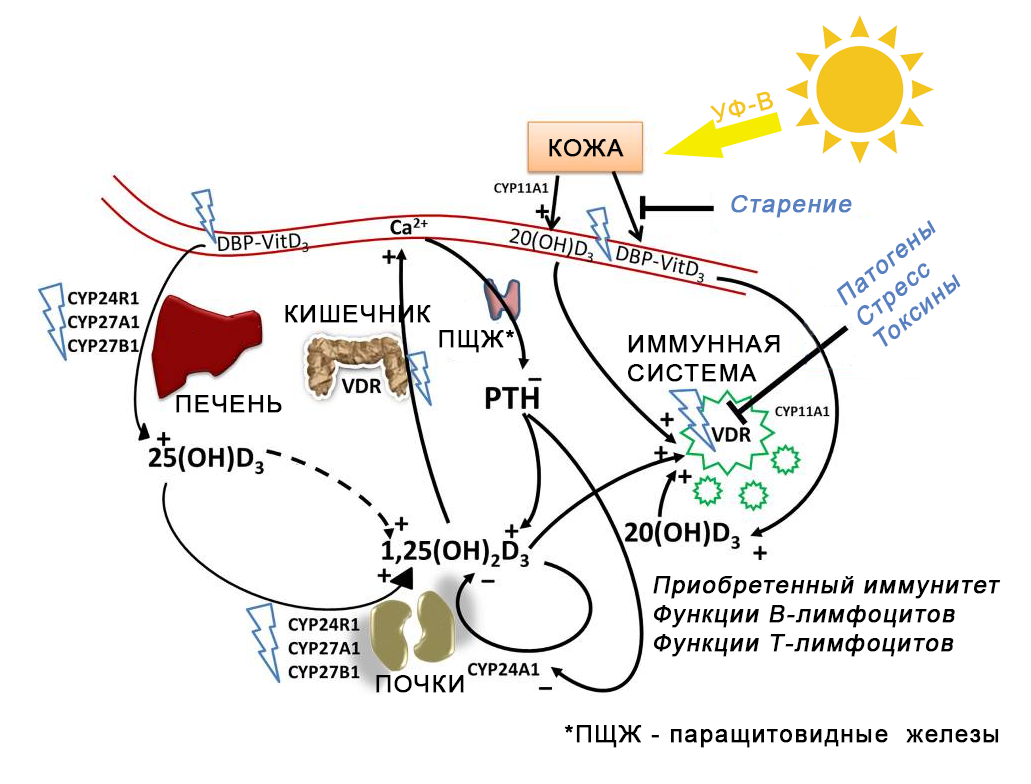
Группа финских исследователей, проводившая два эксперимента с назначением высоких доз витамина D как однократно здоровым, так и на постоянной основе – лицам с наличием аутоиммунной патологии, пришла к выводу, что, несмотря на то, что в их исследованиях использовалось несколько лабораторных тестов, наиболее адекватно отображает картину предполагаемой приобретенной резистентности уровень паратиреоидного гормона (ПТГ).
Действительно, сочетание нормальных уровней витамина D (в его форме 1,25(OH)2 D3) в крови с неизвестно почему повышенным ПТГ, который обычно увеличивается в ответ на недостаток витамина D, заставляют заподозрить какие-то проблемы в обратной связи между двумя этими параметрами. При условии, что потребление кальция и фосфора с пищей является адекватным и гиперпаратиреоза у человека нет, высокие значения ПТГ указывают на резистентность к витамину D. Например, если лабораторный референтный диапазон ПТГ составляет 15–65 нг/мл, уровень, при достижении которого уже можно подозревать приобретенную резистентность к витамину D, – это 23,3 нг/мл.
Также заподозрить приобретенную устойчивость к витамину D можно и по соотношению высоких концентраций 1,25(OH)2 D3 (кальцитриола) в сыворотке крови с одновременной физиологической концентрацией другой формы витамина D – 25(OH)D3. Такое сочетание наблюдалось при наследственных формах резистентности к витамину D и у мышей, у которых были проблемы с рецептором к витамину D. Концентрация кальцитриола определяется, с одной стороны, активностью ферментов CYP2R1, CYP27A1 и CYP27B1, катализирующих образование кальцитриола, и, с другой стороны, CYP24A1, катализирующего распад кальцитриола.
Инактивация кальцитриола происходит либо системно, либо локально внутри клеток тканей-мишеней. Поскольку ПТГ отрицательно регулирует CYP24A1 и положительно регулирует гидроксилазы, превращающие 25(OH)D3 в 1,25(OH)2 D3, наличие резистентности к витамину D, которая приводит к низкой абсорбции кальция в кишечнике и, следовательно, к стимуляции ПТГ, может привести к постоянному повышению кальцитриола.
Если же из-за однонуклеотидных полиморфизмов нарушен ответ рецептора к витамину D, уровни кальцитриола также повышаются, чтобы поддержать передачу сигналов рецептором, – то есть повышенная концентрация ПТГ может быть результатом резистентности к витамину D, опосредованной нарушением передачи сигналов VDR. Отсюда следует, что снижение соотношения 25(OH)D3/1,25(OH)2 D3 можно рассматривать как биомаркер резистентности к витамину D. Однако достоверность этого маркера вызывает определенные сомнения.
Так, например, известно, что некоторые случаи резистентности к витамину D основаны на однонуклеотидных полиморфизмах в ферментах, катализирующих выработку кальцитриола (типа CYP27B1), что приводит к тому, что уровень ПТГ в крови у таких лиц будет повышен, но его воздействие на экспрессию дефектных ферментов будет недостаточным для повышения уровня кальцитриола.
Рецептор витамина D как главная точка слома системы
Как видно на картинке выше, приобретенная резистентность к витамину D может возникнуть в результате множественного полиморфизма генов, экспрессирующих различные белки в системе витамина D: ферменты цитохрома P450 (гидроксилазы), необходимые для превращения витамина D2 /D3 в активированную форму (CYP2R1, CYP27A1 и CYP27B1); DBP, необходимый для транспорта витамина D; рецептор клеточной поверхности мегалин-кубилин, который является мембранным рецептором для комплекса кальцитриол/DBP; сам VDR; или недавно открытые другие рецепторы гидроксипроизводных витамина D RORα и RORγ.
Действительно, инактивирующие полиморфизмы генов CYP2R1 или CYP27B1, полиморфизмы промоторов CYP24A1 или RORA и однонуклеотидные полиморфизмы гена рецептора к витамину D VDR связаны с аутоиммунными заболеваниями. Однако, судя по результатам исследований, именно рецептор к витамину D является наиболее уязвимой частью системы витамина D и способен вызвать наиболее выраженные последствия.
Рецептор к витамину D VDR представляет собой стероидный рецептор, экспрессируемый почти во всех типах клеток человеческого организма, и более всего – в иммунной системе. В клетке VDR обычно находится в ядре (75-80%), но может быть и в цитозоле (15-20%) и совсем немного – в плазматической мембране. Связывание кальцитриола индуцирует транслокацию цитозольных VDR в ядро в зависимости от дозы, времени и температуры. В ядре лигандированный VDR образует гетеродимер с нелигандированным рецептором ретиноида-X, который затем связывается с ДНК и рекрутирует либо коактиваторные, либо корепрессорные белки и другие транскрипционные факторы для осуществления регуляторных функций гена.
Высокая важность VDR подчеркивается большим количеством генов, которые он регулирует как в качестве классического транскрипционного фактора, так и посредством эпигенетических эффектов. Так, например, в одном из исследований было показано, что связывание кальцитриола с VDR модулирует транскрипцию 1204 генов в моноцитарной клеточной линии человека THP-1 в течение 24 часов. Эта эпигенетическая функция VDR проявляется почти во всех типах тканей, что подчеркивает его важную роль как регуляторного белка, выводя его далеко за рамки известной нам роли регулятора кальциевого обмена.
Также было обнаружено несколько однонуклеотидных полиморфизмов этого рецептора, которые связаны с множественными аутоиммунными заболеваниями как по отдельности, так и в виде гаплотипов. Например, для рассеянного склероза недавний мета-анализ выявил значительную связь с полиморфизмом rs731236 (TaqI). Генотип rs731236 GG вместе с генотипом CC rs7116978 (ген CYP2R1) также был важным предиктором невыраженного ответа на лечение витамином D в исследовании с участием 100 женщин. Интересно, что распространение последнего из указанных генотипов, по всей видимости, зависит от национальности человека.
Вероятно, что однонуклеотидные полиморфизмы в VDR могут предрасполагать к приобретенной резистентности к витамину D, которая может проявиться с возрастом и привести к развитию аутоиммунного заболевания, если накопятся дополнительные факторы, способствующие нарушению передачи сигналов VDR.
Дополнительные факторы, влияющие на рецептор витамина D и развитие приобретенной резистентности
VDR – очень старый регуляторный белок. Так, например, он встречается уже у позвоночных возрастом 550 миллионов лет. Поэтому неудивительно, что на него влияет множество факторов.
В первую очередь, это глюкокортикостероиды (ГКС). ГКС (кортизол, кортизон) выделяются в нашем организме как ответ на стресс и обеспечивают поступление энергии, необходимой для решения поставленной задачи. Таким образом, их угнетающее воздействие на VDR вполне логично и осуществляется в рамках «обужения» функций для передачи всей энергии двигательной системе (реакция «бей или беги»).
Однако если VDR подавляется хронически – например, при длительном приеме ГКС или в ситуации хронического стресса – это может привести к остеопорозу и другим уже не физиологическим последствиям. Так, например, в одном из исследований прием здоровыми мужчинами 10 мг преднизолона в течение семи дней приводил к усилению почечной экскреции кальция, повышению биомаркеров костной дегенерации и повышению уровня ПТГ, что могло быть, в свою очередь, компенсировано введением кальцитриола.
Другое исследование показало, что дексаметазон способен усиливать VDR-опосредованную транскрипцию CYP24A1 за счет механизма, включающего вовлечение глюкокортикоидного рецептора в область промотора CYP24A1 и его взаимодействие с C/EBPβ (дексаметазон эффективно снижал концентрацию кальцитриола).
Также в гене VDR обнаружены множественные вероятно чувствительные к глюкокортикостероидам элементы, что предполагает регуляцию экспрессии VDR посредством эндогенных глюкокортикоидов. Это предположение подтверждается, например, тем, что у лиц с диабетом II типа наблюдается как более высокая секреция кортизола, так и более низкие уровни мРНК и белка VDR по сравнению со здоровыми людьми из контрольной группы. В целом, при введении дексаметазона можно наблюдать как ингибирующее, так и активирующее тканеспецифическое воздействие на VDR.
Иммуносупрессивный эффект глюкокортикостероидов также можно частично объяснить блокадой VDR, как и положительный иммуномодулирующий эффект лечения низкими дозами кортизола, который, вероятно, тоже обеспечивается через воздействие на рецептор витамина D.
Также на рецептор витамина D влияют и эстрогены. Они, по-видимому, положительно стимулируют метаболизм витамина D посредством прямого воздействия на VDR.
Кроме того, в ходе эволюции возникли и другие патофизиологические механизмы, судя по всему, направленные на обход иммунной системы, поскольку витамин D широко влияет на процессы иммунитета. Так, например, кальцитриол подавляет в экспериментах опухолевый рост ряда клеток. Было показано, что клетки колоректального рака регулируют экспрессию или чувствительность VDR, а блокада VDR – один из механизмов, используемых клетками остеосаркомы.
В следующей части нашей статьи мы поговорим о еще одной группе внешних факторов, влияющих на систему витамина D – инфекциях, а также об иммунных последствиях таких влияний.




