Резистентность к витамину D как возможная причина аутоиммунных заболеваний – последствия слома системы

Протокол Коимбры – новый, экспериментальный вид лечения аутоиммунных заболеваний при помощи сверхвысоких доз витамина D. В основе его лежит теория о приобретенной, а не врожденной, резистентности к витамину D, которая может развиваться под воздействием множества факторов – старения, гормонального воздействия, стресса, инфекций... Три года назад немецкие ученые опубликовали обзор исследований, касающихся этой гипотезы и подробно рассматривающий механизмы нарушений в системе витамина D, приводящих к иммунологическим последствиям1.
Мы публикуем пересказ основных тезисов этого обзора, и в этой статье коснемся влияния инфекций на одну из ключевых точек управления системой обмена витамина D – рецептор к витамину D VDR, а также рассмотрим последствия, которые вызывает в иммунной системе гиповитаминоз витамина D и его форм.
VDR и инфекционные агенты
Помимо гормонов, большое влияние на рецептор к витамину D оказывают патогены. Все больше исследований склоняются к тому, что этот рецептор – стратегическая мишень различных инфекционных агентов. Например, токсины бактерий, вызывающих сепсис, химически представленные липополисахаридами, ингибируют экспрессию VDR в клетках модели THP-1 (клеточная модель для изучения моноцитов человека).
Бактерии Aeromonas salmonicida, Legionella pneumophila, кишечная палочка и иерсинии «любят» активировать в наших клетках белок каспазу-3, ответственный за запрограммированную гибель клеток (т.н. «апоптоз»). Помимо апоптоза, этот белок ингибирует и внутриклеточный метаболизм витамина D путем связывания и выключения рецептора к витамину D, и его активация микроорганизмами приводит к клеточной гибели и ослаблению иммунного ответа человека.
Также блокируют VDR и другие микроорганизмы. Так, одно из исследований изучало взаимодействие Borrelia burgdorferi на транскриптом моноцитов с использованием полногеномных микрочипов. Этот метод позволил констатировать, что живые боррелии способны уменьшать количество VDR в шестьдесят раз!
Вирус Эпштейна – Барр в В-лимфоцитах человека ингибирует экспрессию мРНК и белка рецептора к витамину D. Группа Yenamandra даже нашла белок, который обеспечивает этот эффект – он называется EBNA-3 и ответственен за блокаду VDR благодаря своему сродству к связыванию с рецептором.
Родственный вирусу Эпштейн – Барр цитомегаловирус на 88% ингибирует экспрессию VDR в инфицированных клетках, что приводит к постепенному увеличению гена CYP27B1 до 970%. Не наблюдалось снижения регуляции VDR при гриппе или аденовирусной инфекции.
Все это важно для того, чтобы понять, какие механизмы обеспечивают связь между инфекциями и развитием аутоиммунных заболеваний, поскольку вирус Эпштейн – Барр, вирусы гриппа или кампилобактерии давно уже рассматривают как триггеры возникновения синдрома Гийена – Барре, при котором иммунная система атакует отдельные участки периферической нервной системы, а вирус Эпштейн – Барр сам по себе – как триггер развития рассеянного склероза. Механизмы нарушения патогенами передачи сигналов в системе витамина D могут быть тем самым недостающим звеном теорий про инфекционно обусловленный патогенез аутоиммунных заболеваний, тем более что это предположение отлично вписывается в эволюцию микроорганизмов, в ходе которой они искали новые и новые пути обеспечить временную или постоянную блокаду VDR, чтобы подавить иммунный ответ хозяина.
Таким образом, воздействие инфекционных агентов, по-видимому, обеспечивает обусловленную полиморфизмами ключевых генов прогрессирующую тяжелую форму низкой чувствительности к витамину D, что влияет на восприимчивость таких людей к аутоиммунным заболеваниям.
«На пару» с инфекцией работают и еще несколько факторов окружающей среды: недостаточное пребывание на солнце; старение (поскольку абсорбция витамина D3 в кишечнике, эндогенная продукция его в коже и гидроксилирование уменьшаются с возрастом) и ряд других факторов токсического характера. Например, алюминий, который был обнаружен в высоких концентрациях в тканях головного мозга пациентов с рассеянным склерозом, способен снижать активность почечного CYP27B1 у кур. Авторы обзора отмечают, что исследования воздействия алюминия (а также и кадмия, который «подозревают» в аналогичном негативном воздействии) на систему витамина D еще не проводились и эти допущения – всего лишь предположения.
В целом сбой в системе витамина D можно представить в виде следующей фигуры.
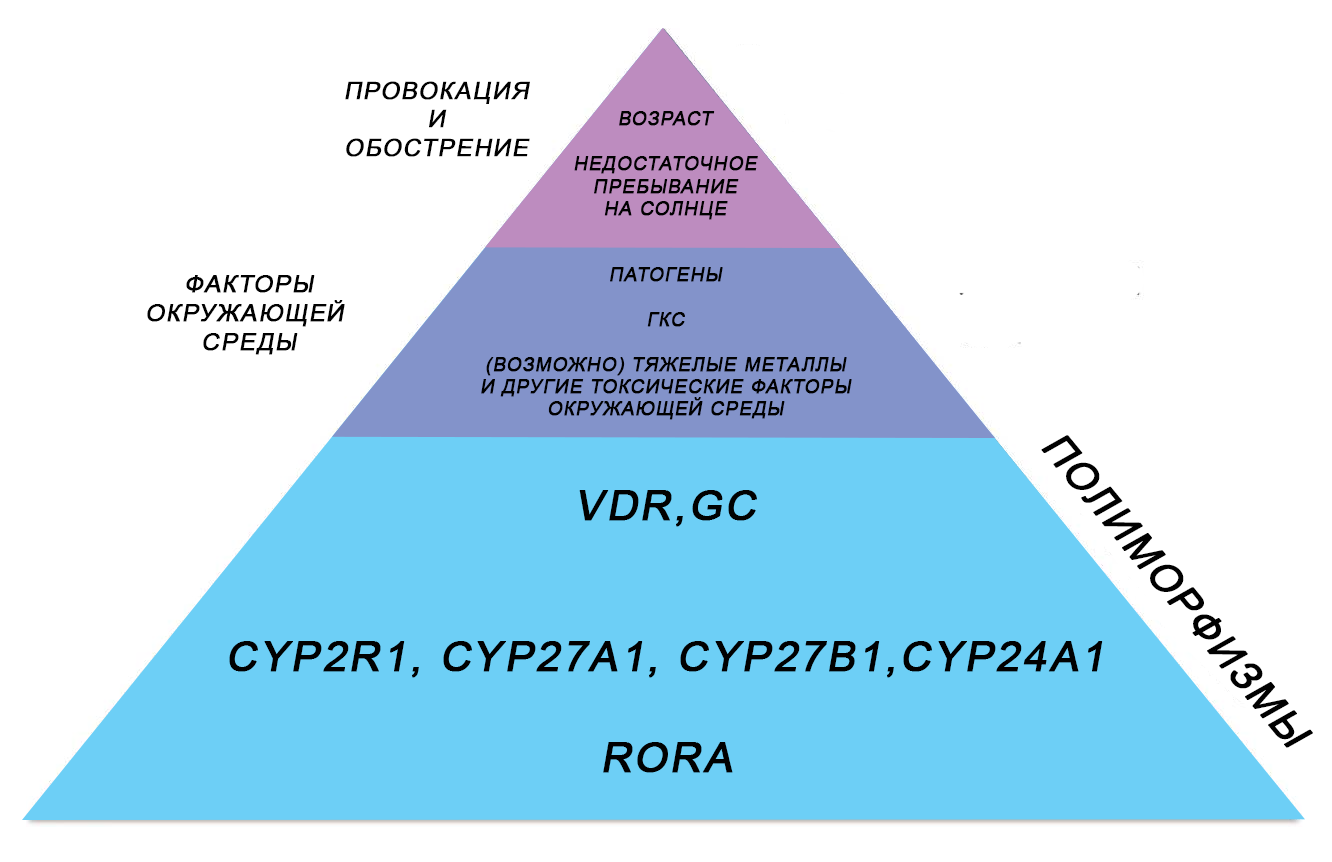
Таким образом, полиморфизмы генов составляют основу предрасположенности к развитию резистентности к витамину D и, следовательно, к аутоиммунным заболеваниям. Частичная блокада рецептора витамина D патогенами, глюкокортикоидами (хронический стресс) и, предположительно, тяжелыми металлами может взаимодействовать с индивидуальной предрасположенностью, приводя к возникновению резистентности к витамину D. Недостаточное пребывание на солнце и старение, которые также коррелируют с аутоиммунными заболеваниями, еще больше усугубляют ситуацию.
Последствия резистентности к витамину D
Так как VDR экспрессируется в качестве генного регуляторного белка почти во всех тканях человеческого организма, очевидно, что его функция касается не только привычного нам управления метаболизмом кальция. Современные модели все больше и больше склонны рассматривать витамин D как фактор, необходимый для поддержания физиологического гомеостаза. Дефицит витамина D связан с множеством сердечно-сосудистых и метаболических заболеваний, включая рак, гипертоническую болезнь, инфекционные и аутоиммунные заболевания. Экспрессирование рецептора к витамину D во многих типах клеток иммунной системы – таких как CD4+/CD8+ лимфоциты, нейтрофилы и активированные Т-клеточные лимфоциты или антигенпрезентирующие клетки (моноциты, макрофаги или дендритные клетки) – подчеркивает важность VDR для иммунитета.
Фактически, на данный момент уже описаны многочисленные различные эффекты кальцитриола на иммунную систему, включая, помимо прочего, хемотаксис, фагоцитоз, пролиферацию, дифференцировку, продукцию цитокинов, презентацию антигена, образование антител, кателицидина и перекиси водорода, выработку и дозревание клеток памяти. В частности, не так давно группа под руководством Carlberg идентифицировала ряд ключевых генов иммунной системы, которые экспрессируются VDR через активацию кальцитриола.
Помимо генов, белки которых играют важную роль во врожденном иммунитете, продуцируя антимикробные пептиды, была идентифицирована еще одна группа белков, тесно связанных с аутоиммунными процессами. Например, трансмембранный белок Ninjurin1 (NINJ1), который регулируется кальцитриолом и участвует в трансмиграции антигенпрезентирующих клеток через гематоэнцефалический барьер и в патогенезе рассеянного склероза.
Также существует и эпигенетическое влияние рецептора к витамину D на гены иммунной системы. Например, в одном исследовании на животных моделях изучалась доступность хроматина в моноцитах, полученных от человека до и после единократной дозы витамина D в 2000 мкг (80 000 МЕ). Эта болюсная доза, которая через два дня повысила уровень 25(OH)D3 на 7,6 нг/мл, привела к открытию/закрытию сотен генных локусов, наиболее заметные из которых принадлежали системе лейкоцитарного антигена человека (HLA), кодированной на 6 хромосоме. С помощью этих антигенпрезентирующих белков иммунная система различает эндогенные и экзогенные белки. Следовательно, дисфункция системы HLA предрасполагает к развитию аутоиммунных заболеваний. Так, известно, что полиморфизмы системы HLA оказывают наиболее значительное генетическое влияние на рассеянный склероз, а в HLA-DRB1, который тесно связан с развитием рассеянного склероза, находится чувствительный к витамину D элемент. Помимо эпигенетического влияния, это открытие также подчеркивает транскрипционное влияние витамина D на патогенез рассеянного склероза.
Также полиморфизмы генов системы витамина D имеют и существенные связи с самыми распространенными типами рака (рак простаты, рак молочной железы, колоректальный рак и рак кожи). Авторы обзора предполагают, что частичная блокада VDR инфекционными агентами у таких больных может быть еще одним способом реализации инфекционной составляющей этиологии рака.
Как лечить?
В настоящее время не существует надежных методов лечения блокады VDR, воздействующих на ее причину. Из практических – но пока что недостаточно подтвержденных – терапевтических методик можно упомянуть только Протокол Коимбры, о котором мы писали в статье «Протокол Коимбры – когда сверхдозы витаминов не являются вредом»2.
Идея Коимбры не нова – так, подобная схема применяется, например, для преодоления резистентности к инсулину. Современная практика лечения диабета 2 типа заключается в расчете необходимой дозы внешнего инсулина в зависимости от уровня глюкозы в крови. Таким образом, практически не имеет значения, насколько высока на самом деле введенная доза инсулина. Именно коррекция целевого параметра, т.е. уровня глюкозы в крови, имеет решающее значение. Для достижения этой цели можно использовать общие суточные дозы инсулина, превышающие 100 МЕ – то есть дозы, которые при отсутствии основной резистентности к инсулину были бы токсичными. Пациент с диабетом в некоторой степени защищен от серьезных побочных эффектов, которые обычно считаются передозировкой, поскольку эта доза действует только физиологически – при условии, что применяемые дозы рассчитаны правильно и под тщательным наблюдением врача.
Что же касается конкретных цифр, то при рассеянном склерозе, например, доза витамина D3 может достигать 1000 МЕ на кг массы тела.
|
Патология |
Начальная доза витамина D3 [МЕ/кг массы тела] |
|
Рассеянный склероз |
1000
|
|
Ревматоидный артрит, СКВ, НЯК, псориатический артрит, псориаз, болезнь Крона, язвенный колит |
300-500 |
|
Системная склеродермия, анкилозирующий спондилит, тиреоидит Хашимото |
300 |
Проблемой Протокола считается гиперкальциемия, которая неизбежно должна сопровождать подобные дозировки витамина. Однако, по всей видимости, тот же механизм, который приводит к дефициту витамина, не дает развиться и гиперкальциемии.
Несмотря на это, назначения Протокола всегда прикрываются специфической диетой, требующей жесткого контроля молочных продуктов и минимального потребления жидкости от 2,5 л/день.
Таким образом, следует заключить, что гипотеза о приобретенной формы резистентности к витамину D, вероятно, вполне обоснована. Полиморфизмы в генах системы витамина D могут сделать человека предрасположенным к развитию низкой чувствительности к витамину D, причем приобретенная резистентность к витамину D является крайней формой, усугубляемой другими факторами, вызывающими блокаду рецептора витамина D (недостаточное пребывание на солнце, старение или токсические воздействия окружающей среды). При этом между уровнем витамина D и кальция в крови у таких лиц не существует линейной или экспоненциальной зависимости.
Главным диагностическим маркером подобного состояния и информацией для определения дозы витамина D3 при аутоиммунных заболеваниях на данный момент выступает уровень паратиреоидного гормона.
Также вероятно, что высокодозовая терапия витамином D3 может оказаться полезной и при лечении рака, диабета и сердечно-сосудистых заболеваний.




