Перспективы лассо-пептидов в медицине
Открытие лариоцидина – продукта Paenibacillus sp. M2, выделенного в 2024 году, подчеркивает важность исследования редких бактерий-продуцентов и использования геномного майнинга. Несмотря на то, что для оптимизации свойств и подтверждения клинической эффективности нового антибиотика необходимы дальнейшие исследования, он уже показал многообещающие результаты.
Однако он не единственный представитель своего вида.
Что такое лассо-пептиды
Упомянутый выше лариоцидин представляет собой первый лассо-пептид, который рассматривают как зачинателя целого класса новых антибиотиков. Но его группа представляет собой огромное семейство, в котором есть еще несколько многообещающих представителей1.
Эта группа – это так называемые рибосомально синтезируемые и посттрансляционно модифицированные пептиды (RiPPs), выделяемые в процессе своей жизнедеятельности грамположительными бактериями типа Actinobacteria и Firmicutes (к которым относится и уже знакомая нам Paenibacillus), а также рядом грамотрицательных бактерий. Они характеризуются уникальной топологией, напоминающей узел, где N-концевой макроциклический кольцевой участок (обычно 7–9 аминокислот) фиксирует C-концевой хвост, создавая стабильную, устойчивую к протеазам и высоким температурам структуру.
Химическая характеристика лассо-пептидов
Лассо-пептиды состоят из 15–30 аминокислот и обладают характерной формой, обеспечившей им название.
Упомянутое выше макроциклическое кольцо образуется за счет изопептидной связи между N-концевой аминокислотой (обычно глицин или цистеин) и боковой цепью аспартата или глутамата. Через кольцо проходит C-концевой хвост, фиксируясь стерическими взаимодействиями или дисульфидными мостиками.
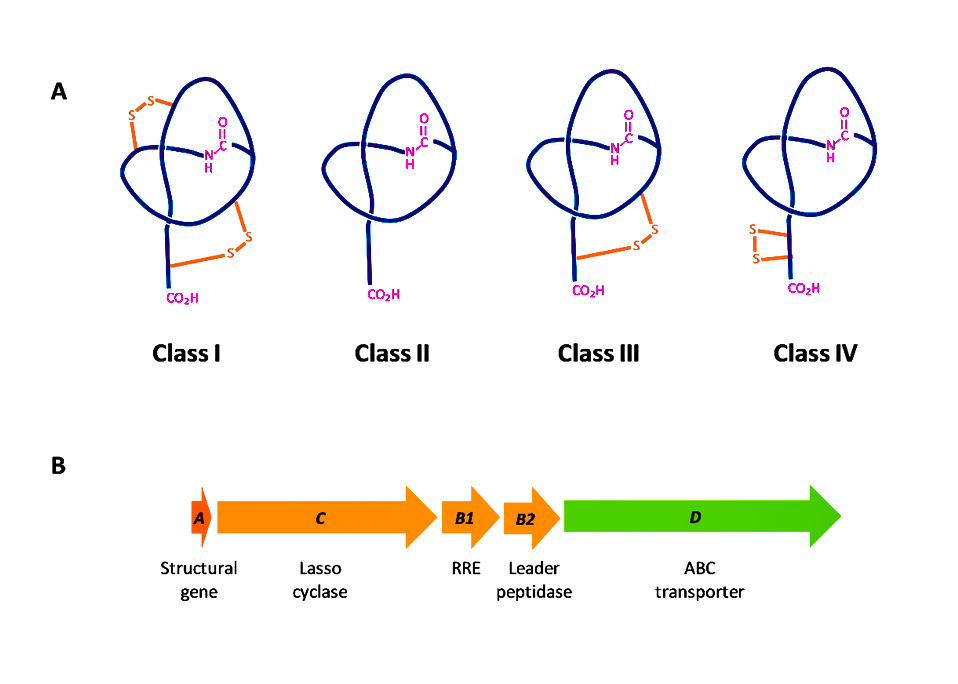
В зависимости от наличия дисульфидных связей, лассо-пептиды делятся на классы:
- I (с двумя дисульфидными связями),
- II (без дисульфидных связей, топология стабилизируется только стерическими взаимодействиями),
- III (с одной дисульфидной связью между макроциклическим кольцом и хвостом),
- IV (с одной дисульфидной связью в хвосте).
Большинство изученных до сих пор лассо-пептидов класса II выделяются Proteobacteria, а лассо-пептиды, принадлежащие классам I, III и IV, – Actinobacteria.
Стабильность молекулы лассо-пептидов обусловлена плотной упаковкой, что делает их устойчивыми к протеолитическому расщеплению, экстремальным pH и температурам до 100°C.
Именно эта структура лассо-пептидов описана в первой из систематических работ, посвященных данному классу соединений, которая вышла в 2012 году, хотя первые упоминания их встречаются в научной литературе с 90-х годов прошлого столетия1.
Так, например, первый лассо-пептид с антимикробной активностью под названием анантин был выделен из Streptomyces в 1991 году. Также в 90-те был выделен и еще один лассо-пептид, микроцин J25 (microcin J25). Его продуцентом была Escherichia coli, полученная из кала новорожденных, и он обладал свойством ингибировать РНК-полимеразу, из-за чего стал модельным лассо-пептидом для изучения структуры и биосинтеза этих веществ.
С развитием геномного майнинга число известных лассо-пептидов значительно возросло, и к 2024 году было описано уже более 50 таких соединений. При этом большинство из них обладали антимикробной, противовирусной или противораковой активностью2.
Лариоцидин, выделенный в 2025 году, отличается от своих собратьев уникальным свойством ингибировать бактериальную рибосому.
Механизмы действия
Лассо-пептиды воздействуют на патоген множеством способов, из-за чего привлекают внимание ученых, надеющихся отыскать среди представителей этой группы идеальный антибиотик, который бы воздействовал на все возможные бактерии и к которому бы не развивалась резистентность. К примеру, антимикробная активность микроцина J25 реализуется путем ингибирования РНК-полимеразы, что блокирует транскрипцию в грамположительных и грамотрицательных бактериях; лариатин нацелен на ClpC1 – компонент протеазного комплекса у Mycobacterium tuberculosis – и вызывает гибель бактерии, не затрагивая клетки человека; а лариоцидин связывается с малой субъединицей рибосомы (30S), нарушая трансляцию и вызывая ошибки декодирования. Исследования показывают, что последний эффективен также и против метициллинрезистентного золотистого стафилококка, мультирезистентных штаммов Acinetobacter baumannii и других устойчивых патогенов, что делает его главным кандидатом на роль «универсального антимикробного солдата».
Лассо-пептиды обладают также и противовирусной активностью (например, L'астексин-1, ингибирует вирусные протеазы, демонстрируя потенциал против ВИЧ), а также могут взаимодействовать с онкогенными белками, такими как MDM2, который ингибирует CD8+ и CD4+ T-клетки через p53-зависимый путь и мешает им эффективно устранять опухолевые клетки3.
Помимо разнообразных механизмов воздействия на патоген, ученых привлекают в лассо-пептидах также их специфичность и низкая вероятность перекрестной резистентности с существующими антибиотиками, что делает лассо-пептиды перспективными кандидатами для борьбы с супербактериями4.
Проведенные исследования
В 20 веке поиск новых антибиотиков проводился в основном функциональным скринингом бактерий-продуцентов, но на данный момент такой подход во многом себя исчерпал. Однако ученые быстро переориентировались.
Дело в том, что бактерии производят массу биоактивных веществ – но не постоянно. Считается, что как минимум три четверти специализированных метаболитов не вырабатываются микроорганизмами на постоянной основе, и потому чаще всего их продукцию невозможно обнаружить в условиях стандартного лабораторного культивирования. И тогда на помощь приходят технологии наподобие молекулярной биологии и высокопроизводительного секвенирования. Благодаря тому, что гены, отвечающие за биосинтез специализированных метаболитов, часто переносятся горизонтально, они имеют тенденцию образовывать кластеры в бактериальных геномах. Биоинформатический поиск кластеров генов биосинтеза позволил открыть множество новых классов соединений, а благодаря совершенствованию инструментов манипуляций с геномами бактерий, переносу кластеров генов в модельные микроорганизмы, а также широкому использованию масс-спектрометрических методов изучение специализированных метаболитов, в том числе – лассо-пептидов, вышло на новый уровень.
Примером геномного майнинга служат, в первую очередь, алгоритмы наподобие RODEO, позволившие идентифицировать тысячи потенциальных BGC лассо-пептидов в геномах бактерий. Так, анализ геномов Paenibacillus dendritiformis выявил новые пептиды, в том числе – паенинодин5.
К структурным исследованиям относятся криоэлектронная микроскопия и ЯМР-спектроскопия, которые раскрыли детали лассо-топологии и взаимодействия с мишенями. Например, структура лариоцидина показала его уникальное связывание с рибосомой4.
При помощи генной инженерии ученые «заставили» эталонную бактерию, используемую в промышленном производстве множества лекарств, Streptomyces, а также E. coli вырабатывать лассо-пептиды, что значительно упростило их производство. А химическая модификация (например, введение ненатуральных аминокислот) позволила улучшить их стабильность и активность6.
Что касается перспектив применения лассо-пептидов в качестве лекарств для людей, то на данный момент, помимо лабораторных исследований биохимической активности, для ряда представителей этого класса уже проведены и опыты над животными4.
Перспективы использования в медицине
Лассо-пептиды обладают значительным потенциалом в медицине благодаря своим уникальным свойствам.
Так, как антибиотики нового поколения сейчас рассматриваются лариоцидин и лассомицин (синтезирован в 2014 году). Оба эффективны против мультирезистентных патогенов и имеют низкий риск возникновения перекрестной резистентности, что делает их кандидатами для лечения, например, внутрибольничных инфекций, устойчивых к большинству традиционных антибиотиков.
Могут быть лассо-пептиды и противовирусными препаратами за счет ингибирования вирусных протеаз или рецепторов, что позволяет рассматривать их как средства для лечения ВИЧ, гепатита C или SARS-CoV-2.
Не меньшие перспективы открываются для представителей этого класса веществ, взаимодействующих с онкогенными путями (например, уже упомянутыми выше MDM2/p53), – они могут стать основой для таргет-терапии рака. Их компактная структура облегчает доставку в клетки.
Нестандартной, но вполне реальной перспективой является использование лассо-пептидов в качестве биомедицинских материалов – например, биосенсоров, наноносителей лекарств или пептидных конъюгатов.
Ну и, наконец, лассо-пептиды – идеальные «союзники» персонализированной медицины. Возможность инженерного дизайна лассо-пептидов позволяет создавать молекулы с заданной активностью, например, для таргетинга специфических патогенов или опухолей7.
Ограничения
Несмотря на перспективы, для медицинского применения лассо-пептидов существуют и ограничения. Так, например, несмотря на многообещающие результаты предварительных изысканий, ни один из лассо-пептидов еще не прошел полную фармакокинетическую оценку. Долгосрочные исследования необходимы и для оценки риска появления резистентности, особенно для пептидов, нацеленных на рибосому или РНК-полимеразу.
Кроме того, для проведения всех необходимых клинических испытаний понадобятся годы.
Производство всей этой группы веществ также, несмотря на успехи гетерологичной экспрессии, остается дорогостоящим, а химический синтез сложен из-за топологии8.
Примечания
- 1. a. b. Lasso peptides: structure, function, biosynthesis, and engineering
- 2. Advances in lasso peptide discovery, biosynthesis, and function
- 3. Etude structurale et fonctionnelle de peptides lasso à l’aide de méthodes spectroscopiques
- 4. a. b. c. A broad-spectrum lasso peptide antibiotic targeting the bacterial ribosome
- 5. A new genome-mining tool redefines the lasso peptide biosynthetic landscape
- 6. Lasso peptides as antibiotics: from discovery to design
- 7. New class of antibiotic found in soil sample
- 8. The evolving landscape of RiPP natural products in the genomics era




