Комар – как чашка Петри: новый способ обнаруживать антитела к ковиду

В предыдущей статье «Запах крови – как комары выбирают себе жертву» мы рассказывали, как на выбор комаром жертвы влияют состав микробиома кожи и запах. Для того, чтобы определить степень влияния этих факторов, ученые отсеяли воздействие ряда других – в первую очередь ограничили выборку только мужчинами, поскольку менструальный цикл путем колебания уровня гормонов изменяет множество параметров человеческого метаболизма, в том числе – содержание биоактивных веществ в крови и в тканях тела. Успех исследования 2018 года дал зеленый свет целой серии новых экспериментов – и тем, которые занимались изучением состава крови человека, делающим ту или иную личность более привлекательной для комара, и тем, которые изучали кровь человека уже в комарином желудке. Одно из последних изысканий, в свою очередь, получило очень неожиданный результат.
Ксенонадзор
В прошлом году в Science Direct вышла интересная статья1, резюмирующая плоды работы швейцарских ученых по изучению нового способа находить антитела к человеческим патогенам в пищевых массах в комарином желудке.
Ученые, отталкиваясь от известного факта о возможности использовать кровососущих насекомых для анализа попавшей в их желудок крови жертвы на наличие циркулирующих патогенов или антител, направленных против них, решили проверить, могут ли антитела, приобретенные разнообразными жертвами естественным путем, быть обнаружены с помощью специфических и панспецифических вариантов ферментного иммуносорбентного анализа (ИФА, которым иммунологи определяют наличие определенных антигенов путем реакции антиген-антитело) в пищевых массах в ЖКТ комаров. Это интересовало их в плане возможности расширить методологию надзора за инфекционными заболеваниями, так как взять пробы у потенциальных животных-резервуаров иногда бывает трудно или дорого.
Такой метод мониторинга с использованием анализа крови жертв на патогены, попавшей в пищеварительную систему какого-то кровососущего насекомого, известен науке уже более 6 лет. Использование членистоногих в качестве «летающего шприца» часто называют ксенонадзором или ксенодиагностикой. Новый метод был протестирован для обнаружения вирусов, бактерий и паразитов у ряда членистоногих, которые питались разными жертвами из подтипа Позвоночных. В Габоне, например, с этой целью ловили кровососущих мух и анализировали кровь жертвы в их желудочно-кишечном тракте с помощью ПЦР/секвенирования. Содержимое желудка позволило идентифицировать около 20 видов жертв, принадлежащих к Позвоночным, также были обнаружены известные и неизвестные паразиты.
Суть эксперимента
Однако многие паразиты секвестрированы в организме хозяина и вообще не присутствуют (или присутствуют в очень малом количестве) в крови, поэтому для исследований и надзора более оптимально определять не сами патогены, а антитела против них.
Опыты по обнаружению таких антител в комарах при помощи стандартного ИФА начались уже в 1989 и активно продолжились в 10-тых. Сейчас швейцарские ученые решили проверить, могут ли приобретенные антитела быть обнаружены в находящейся в желудке пище комаров, содержащей кровь разных жертв.
Для опытов была исследована кровь от разных жертв с антителами против одного и того же возбудителя. Так, токсоплазма (Toxoplasma gondii) может инфицировать не только людей, но и других млекопитающих и птиц, поэтому является очень хорошим объектом для подтверждения или опровержения стартовой гипотезы о возможности ксенонадзора путем исследования пищевых масс в желудке комаров. Комаров кормили кошачьей, человеческой, свиной, овечьей и куриной кровью или плазмой крови с антителами к токсоплазме и анализировали их брюшную полость через некоторое время после кормления.
Еще одним агентом стал вирус ковида SARS-CoV-2, поскольку коронавирусной инфекцией активно болеют животные – это типичный зооноз, пришедший к нам от «братьев меньших». Ученые искали антитела против спайкового белка SARS-CoV-2 в пищевых массах комаров, получивших кровь от иммунизированных альпак.
Обычно ИФА зависит от детектирующего антитела, специфичного для жертвы, что делает метод непригодным для мониторинга нескольких видов жертв. Поэтому ученые разработали модификацию стандартного ИФА – панспецифический ИФА с использованием конъюгированного протеина A/G для обнаружения антител у жертв-млекопитающих и анти-IgY – у жертв-птиц.
В качестве агрессоров выступали комары Aedes japonicus, которых выращивали из яиц. Их специально морили голодом за 24 часа до приема пищи, чтобы они охотнее употребляли предложенную кровь. Через полтора часа после кормления комаров выпускали в клетку размером 17,5 × 17,5 × 17,5 см, где всех некормящихся или частично накормленных комаров удаляли путем аспирации, а оставшихся накормленных кровью самок каждый день поили свежим 5% раствором глюкозы. Затем группы из 4–7 накормленных кровью комаров удаляли из клетки в разные моменты времени и хранили при температуре -20 °C, после чего проводили ИФА. Все образцы из эксперимента тестировали в одних и тех же условиях в одном и том же цикле анализа.
Поскольку комары не питаются плазмой крови, образцы были обогащены цельной кровью человека, которая дала отрицательный результат на антитела к токсоплазме. После центрифугирования цельной крови человека в течение 8 мин при 520×g осадок клеток смешивали в соотношении 1:1 с образцами плазмы.
Панспецифический ИФА
Чтобы иметь возможность обнаруживать антитела в случае, когда жертва комара неизвестна, был опробован метод панспецифического ИФА с использованием конъюгированного со щелочной фосфатазой белка A/G для жертв-млекопитающих и анти-IgY для жертв-птиц. Для повышения чувствительности метода перед анализом брюшки комаров гомогенизировали в меньшем объеме, чем для стандартного ИФА, и использовали 50 мкл супернатанта.
Далее методика была вполне обычной: антиген разбавляли в буфере и вносили порцию в каждую лунку 96-луночного планшета, после чего брюшко комара исследовали с помощью ИФА через 0, 6, 12, 24, 36, 48 и 72 часа после кормления кошачьей кровью, положительной на антитела к токсоплазме.
Иммуноферментный анализ (ИФА) – это метод выявления антигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой (пероксидазой хрена, бета-галактозидазной или щелочной фосфатазой). После соединения антигена с меченой ферментом иммунной сывороткой в смесь добавляют субстрат/хромоген. Субстрат расщепляется ферментом, из-за этого изменяется цвет продукта реакции. Интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител.
Сравнение обычного и панспецифического ИФА
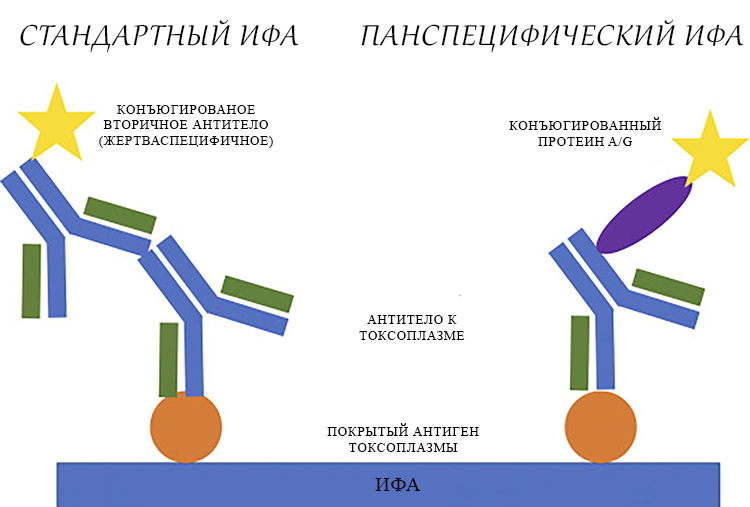
Конъюгированный белок A/G позволяет обнаруживать антитела млекопитающих. Чтобы иметь возможность обнаруживать птичьи антитела, к панспецифическому ИФА добавляли анти-IgY. Далее он работал так же, как и обычный ИФА
Оптическая плотность крови от жертвы с токсоплазмозом отличалась от таковой у здоровой жертвы, и экспоненциально снижалась с течением времени, оставаясь примерно одинаковой в первые 36 часов, но снижаясь в 3 образцах из 4-х через 48 часов. Через 72 часа значения оптической плотности полностью выравнивались и становились идентичными оптической плотности контрольных образцов.
В аналогичных предшествующих исследованиях с использованием ИФА, проведенных с тропическими комарами (Aedes aegypti, различные виды комаров Culex), обнаружение антител было возможно в течение 24–48 часов после кормления. Другие методики позволяли обнаружить антитела против вируса Западного Нила в пищевых массах желудков комара в течение 30 часов.
Длительность промежутка времени, когда обнаружение антител является возможным, зависит от чувствительности выбранного метода анализа, а также от размера пищевого комка и скорости переваривания крови комаром. Скорость пищеварения тропических видов комаров выше – следовательно, обнаружение антител у них возможно на протяжении более короткого периода времени.
Анализ, направленный на поиски антител к вирусу SARS-CoV-2 дал приблизительно такой же результат. Как и в случае с антителами к токсоплазме, значения оптической плотности были отчетливо повышены в течение 24 часов после принятия пищи комаром (более поздние временные точки не тестировались).
Также были интересны и итоги попытки использовать панспецифический ИФА. Так, результаты показали, что конъюгированный белок A/G, который, теоретически, должен связывать антитела класса IgG широкого круга различных млекопитающих, не может обнаруживать антитела к токсоплазме в крови кошек. Однако эксперименты с кровью человека и плазмой свиней и овец (обогащенными кровью человека) прошли успешно. Антитела к токсоплазме в пищевых массах комара с кровью человеческого происхождения исследовали через 0, 6, 12, 24, 36, 48 и 72 часа после кормления, чтобы выявить временной предел обнаружения. Значения оптической плотности держались высокими 48 часов, а иногда – и более 72 часов.
Чтобы подтвердить, что тест будет также эффективен и при работе с кровью другого происхождения, ученые изучили кровь кур, а также обогащенную плазму свиней и овец через 0, 12 и 24 часа после кормления. Антитела к токсоплазме обнаружились и у комаров, питавшихся кровью этих трех видов. Однако анализ с использованием как протеина A/G, так и анти-IgY в одной и той же реакционной смеси привел к значительной потере чувствительности к токсоплазменным антителам в обогащенной овечьей плазме.
Поскольку анти-IgY был взят у коз, которые филогенетически наиболее сходны с овцами, белок A/G, скорее всего, связывается с одним и тем же сайтом, и, следовательно, козий IgG адсорбирует свободный растворимый белок A/G из смеси, и он затем не может связываться с овечьим IgG. Возможные решения этой проблемы могут состоять в том, чтобы сначала добавить белок A/G и добавить анти-IgY после этапа промывки или увеличить количество белка A/G.
Перспективы
Исследование, как можно видеть, продемонстрировало, помимо доказательства успешности идеи ксенонадзора, и ряд неоднозначных результатов, часть из которых имеет объяснение.
Так, тестирование большего количества видов жертв и большего количества их особей, а также различных поставщиков конъюгированного белка A/G могло бы показать, почему возникли наблюдавшиеся в исследовании различия в обнаружении антител от разных жертв.
Что же касается выбора метода тестирования, использующегося для обнаружения антител, то необходимо сказать следующее. Хотя ксенонадзор за патогенами с помощью специфических ИФА и родственных им методик может быть довольно эффективен (особенно когда резервуар-жертва известен), в случае подозревающейся межвидовой передачи (например, когда мы имеем дело с зоонозом типа ковида, полученным человеком от животного) для определения антител лучше использовать панспецифический метод.
Также, хотя существуют и другие методы обнаружения антител, которые не зависят от вида жертвы (например, тесты b-MIA и VecTest), но они имеют еще больше ограничений достоверности – требуют более сложного лабораторного оборудования (b-MIA) или дают большое количество ошибочных результатов (VecTest), – что снова заставляет нас вернуться к выбору панспецифического ИФА для проведения ксенонадзора.
Интересно, что ряд авторов предлагали (но не тестировали) еще один вариант панспецифического ИФА – с захватом антител, при котором Fc-связывающий белок наносится на планшет и связывается с антителами в образцах. Но поскольку метод фиксирует общий IgG, тест может быть менее чувствительным.
Еще одной проблемой, которой коснулось исследование, стал отлов комаров для опытов.
Известно, что отлов кровососущих комаров существенно ограничивает эффективность ксенонадзора, так как после приема пищи комары отдыхают, и их редко привлекают приманки, используемые в ловушках для комаров. Исследование 2014 года, проведенное на ряде комаров Anopheles, показало, что этот вопрос можно решить использованием патоки. Вероятно, это может помочь увеличить эффективность метода и для других подобных насекомых.
Ученые считают, что последующие исследования должны быть сосредоточены на оптимизации методов сбора данных о комарах, питающихся кровью, и усовершенствовании панспецифического ИФА, чтобы определить, наконец, метод обнаружения антител, который подходит если не для всех жертв, то хотя бы для большинства их.
Пандемия SARS-CoV-2 подчеркивает важность эпиднадзора за патогенами и требует более совершенных и новых методов эпиднадзора. Поэтому обнаружение антител, направленных против патогенов, методами ксенонадзора может стать ценным дополнением в арсенале эпидемиолога, поскольку такие антитела обнаруживаются в крови в течение гораздо более длительного времени, чем сам патоген.




