Кишечная флора и сердечно-сосудистые заболевания – есть ли связь?
Современные подходы к патогенезу сердечной недостаточности все больше внимания уделяют роли кишечника1. Это связано с постоянным углублением понимания того, какую важную роль играет физиологическое микробное содружество (микробиота, микробиом) в функционировании наших органов и систем и в развитии или предотвращении заболеваний. На данный момент доказано активное участие микроорганизмов в развитии и регулировании иммунной системы, в том числе – в патогенезе болезни Крона2, астмы и ревматоидного артрита3, инфекционных заболеваний; кишечной патологии типа синдрома раздраженного кишечника и воспалительных заболеваний ЖКТ; метаболических нарушений наподобие сахарного диабета4, метаболического синдрома и ожирения; онкозаболеваний – например, микробиом влияет на эффективность иммунотерапии рака5; а также психиатрических болезней.
Кардиология не стала исключением в этом длинном списке потенциальных точек приложения эффектов естественной микрофлоры нашего кишечника. Одно из последних открытий в этой области – так называемый синдром повышенной эпителиальной проницаемости (СПЭП).
Синдром дырявого кишечника
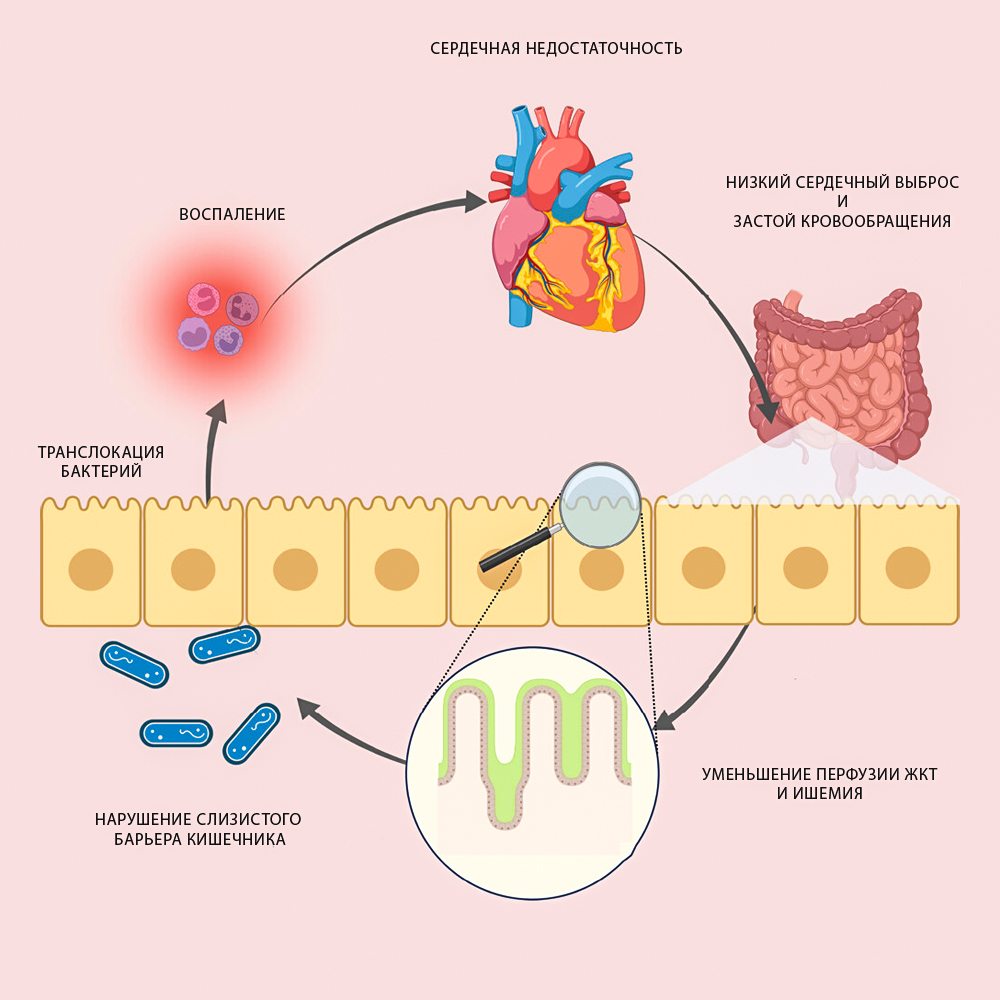
Роль микробиома в развитии и прогрессировании сердечно-сосудистых заболеваний тесно связана с патогенезом сердечной недостаточности. «Кишечная гипотеза» обращает внимания на то, что гемодинамические нарушения, сопровождающие сердечную недостаточность, такие как снижение сердечного выброса и, как следствие, недостаточное кровоснабжение ЖКТ, могут вызвать ишемию и/или отек слизистой, изменение в составе и количестве микробиоты и увеличение проницаемости слизистого барьера кишечника. Эти изменения могут нарушить барьерную функцию кишечника и усугубить системное воспаление из-за того, что микробы и/или их токсины начинают попадать в системный кровоток.
Более того, вещества, возникающие в процессе жизнедеятельности микроорганизмов кишечника (например, триметиламин N-оксид, ТМАО), осуществляют воздействие как на сердечно-сосудистую систему, так и на почки, что может дополнительно опосредовать или модулировать патофизиологию сердечной недостаточности1.
Все это можно объединить под названием «синдром повышенной эпителиальной проницаемости» (СПЭП), или, как образно называют его в западной медицинской традиции, – «синдром дырявого кишечника», который характеризует патологическое состояние, сопровождающееся снижением барьерной функции кишечника и перемещением кишечной микробиоты в кровеносное русло6.
Слизистый барьер
Для того, чтобы понять, каким образом возникает ситуация, позволяющая бактериям и их метаболитами проникнуть в сосудистое русло, рассмотрим строение слизистой оболочки кишечника.
Структура слизистого барьера желудочно-кишечного тракта состоит из трех слоев:
- Слизистый (преэпителиальный) – слой, содержащий в основном гликопротеины (муцин), антимикробные пептиды, секреторный иммуноглобулин IgA. Защищает от инфекционных агентов, физических и химических повреждений (например, пищевых кислот и ферментов), а также играет роль смазки и способствует прохождению веществ по ЖКТ.
- Эпителиальный – тесно связанные между собой клетки эпителия кишечника предотвращают проникновение содержимого через стенку.
- Субэпителиальный – представляет собой слой слизистой, содержащий клетки иммунной системы, которые обеспечивают иммунологическую защиту, распознавая и уничтожая патогены, а также регулируя иммунный ответ кишечника.
Фактически, слизистый барьер кишечника состоит из тесно соединенных друг с другом эпителиальных клеток и слоя плотной слизи, защищающего эти клетки от патологических бактерий и кишечного содержимого. Иммунные клетки, находящиеся под эпителием, нацелены на уничтожение любого микроорганизма, который все же смог пройти через предыдущие слои.
В последнее время эти три компонента рассматриваются вместе с еще двумя составляющими7:
- Микробиота кишечника, которая помогает в поддержании барьерной функции, конкурирует с патогенами за ресурсы, и участвует в модуляции иммунного ответа.
- Антимикробные пептиды (например, α-дефензины) и ферменты, которые секретируются как эпителиальными, так и иммунными клетками, и защищают ЖКТ от патогенных микроорганизмов.
Потенциальные «дыры»
Для того, чтобы вся эта система работала правильно, кишечнику необходимо нормальное кровообращение. Однако ворсинки кишечника – крайне чувствительные к ишемии образования, и при сердечной недостаточности, когда кровоток начинает снижаться и перфузия падает, артерии, которые образуют плотные капиллярные сети вблизи вершины ворсинок, чтобы эффективно передавать кислород, перестают справляться со своими задачами. Наступает так называемая «функциональная ишемия». Считается, что в результате ишемии кишечника и застоя в системном кровообращении изменяются морфология, проницаемость и функция кишечника. Отечность стенки кишечника – одно из таких последствий сердечной недостаточности8.
Еще одна важная «дыра» в слизистом барьере связана с упомянутыми выше антимикробными пептидами. Помимо угнетающего действия на бактерии, они участвуют и в проницаемости эпителиальной стенки.
Так, оклюдины, клаудины, зонулины и дифензины могут выполнять функции открывания и закрывания «шлюзов», через которые проникают как переваренные продукты питания, так и провоспалительные молекулы или даже сами микробы. Этот процесс носит название «транслокация» и является характерным ответом ЖКТ на сердечную недостаточность.
Помимо транслокации микрофлоры, воспаление провоцируют и поддерживают также продукты жизнедеятельности бактерий, в первую очередь – упомянутый выше триметиламин N-оксид. В норме метаболизм его предшественника триметиламина полностью проходит в печени, но при нарушении слизистого барьера его начинает перерабатывать и кишечный микробиом. Получающийся в итоге кардиотоксичный триметиламиноксид попадает в кровоток и оказывает губительное воздействие как на миокард, так и на сосуды.
Считается, что увеличение синтеза триметиламин N-оксида приводит к:
- развитию сердечной недостаточности (прямой эффект) и ремоделированию желудочков;
- гипертрофии миокарда;
- нарастанию фиброза;
- воспалению;
- усилению митохондриальной дисфункции.
Также считается, что триметиламиноксид косвенно связан с нарушением функции почек9.
Таким образом, избыток этого соединения является дополнительным фактором риска для сердечной недостаточности, а также маркером неблагоприятного прогноза СН.
К продуктам жизнедеятельности микробиома относят также и короткоцепочечные жирные кислоты (небольшие летучие алифатические карбоновые кислоты, содержащие от одного до пяти атомов углерода – в основном ацетат, пропионат и бутират), которые образуются из пищевых волокон и отвечают, в частности, за улучшение жизнеспособности клеток на фоне энергодефицита и за поддержание тесного контакта эпителиальных клеток друг с другом – их продукция при сердечной недостаточности падает; способствующие развитию сердечной недостаточности N,N,N-триметил-5-аминовалериановую кислоту, образуемую бактериями из триметиллизина, желчные кислоты и т.д.
Порочные круги воспаления
Еще в 1997 году ученые заметили, что взаимодействие сердечной недостаточности и поражение желудочно-кишечного тракта создают своеобразный порочный круг.
Так, мезентериальный венозный застой при хронической сердечной недостаточности приводит к повышению проницаемости кишечника, что, в свою очередь, способствует бактериальной транслокации и высвобождению эндотоксинов, которые ухудшают воспаление.
Позже, в этот круг «вписали» и метаболиты микробиоты кишечника, а также подтвердили, что такое взаимодействие ухудшает прогноз у больных с СН10.
В настоящее время эта гипотеза получила еще одно уточнение: застой при сердечной недостаточности может вызвать повышенную проницаемость кишечника, за которой следует бактериальная транслокация и воспаление, а изменения в микробиоте кишечника могут усугубить СН через метаболиты (в основном путем увеличения продукции триметиламин N-оксида и падения – короткоцепочечных жирных кислот), и привести к порочному кругу11.
Графически это можно представить следующим образом.
В следующей части нашей статьи мы расскажем о роли отдельных видов микрофлоры кишечника в формировании и усугублении сердечной недостаточности, а также коснемся методов определения нарушений микробиома.
Примечания
- 1. a. b. Intersections between Microbiome and Heart Failure: Revisiting the Gut Hypothesis
- 2. Болезнь Крона: микрофлора кишечника как прогностический фактор развития рецидива
- 3. Ревматоидный артрит: микробиота кишечника изменяется на ранних стадиях заболевания
- 4. Микрофлора кишечника может быть причиной сахарного диабета 1-го типа
- 5. Иммунотерапия еще более эффективна благодаря кишечной микробиоте пожилых людей
- 6. Leaky Gut Syndrome
- 7. The Microbiome in Patients With Inflammatory Diseases
- 8. Gut microbiota in heart failure and related interventions
- 9. Dietary metabolism, the gut microbiome, and heart failure
- 10. Prognostic Value of Elevated Levels of Intestinal Microbe-Generated Metabolite Trimethylamine-N-Oxide in Patients with Heart Failure: Refining the Gut Hypothesis
- 11. Short-Chain Fatty Acids in the Metabolism of Heart Failure – Rethinking the Fat Stigma




