Как разрабатывают и производят вирусные векторы

Недавняя статья Рейтерс о претензиях ЕМА к российской вакцине Спутник V подняла вопрос важности правильного производства вектора – вируса-носителя, поставляющего другой вирусный белок, к которому мы хотим выработать иммунитет, в клетку. Так почему же методика производства простого носителя – настолько решающий фактор?
Генная терапия
Генная терапия – направление хотя и молодое, но успешно и быстро развивающееся. Она основана на использовании геннотерапевтических препаратов – то есть средств, которые в своем составе содержат определенный фрагмент ДНК, определяющий их лечебный эффект. Принцип действия геннотерапевтических препаратов заключается в доставке нового генетического материала (гена или его фрагментов) в клетки-мишени с помощью так называемого «вектора», то есть переносчика, в роли которого сейчас выступают в основном вирусы (вирусные векторы) или плазмидная ДНК (плазмидные векторы). Дело в том, что вирусам свойственно встраивать (интегрировать) при заражении свой генетический материал в механизмы клетки-хозяина, что делает их идеальными кандидатами на роль вектора. Идеальный вирус-вектор должен обладать стабильным геномом, избирательностью к типу клеток, эффективными показателями инфицирования, минимальным влиянием на физиологию инфицированных клеток и минимальной патогенностью.
Вирусные векторы получают так: вирусами, содержащими необходимый ген, инфицируют культивируемые клетки. Затем эти клетки производят и выделяют в культуральную среду дополнительные копии вируса, которые собирают и очищают. Выход, чистота и качество вирусных векторов, получаемых во время этого процесса, влияют на эффективность последующей процедуры трансдукции (вирусного заражения вектором), которая, в свою очередь, влияет на качество и эффективность получения конечного биологического препарата.
Гендицин – первый препарат такого типа, одобренный у людей для лечения сквамозно-клеточного рака кожи головы и шеи в 2003 году, запустил целую плеяду новых средств. Так, в 2015 году в США на препараты для лечения онкологических заболеваний геннотерапевтическим методом было потрачено 805,5 миллионов долларов, и рост этого рынка, согласно прогнозам, до 2024 года должен превысить 20%1.
Плюсы и минусы векторов
Геннотерапевтические препараты обладают высокими избирательностью и эффективностью. Их считают хорошей альтернативой даже терапии рекомбинантными белками, потому что они работают в клетках-мишенях от одной до нескольких недель и обеспечивают менее резкое и более длительное повышение содержания ангиогенного фактора, из-за чего вводятся реже, чем белки, и меньше аллергизируют организм. Так, например, все тот же гендицин, который используется в комбинации с радиотерапией, у 64% пациентов вызывает полный регресс симптомов и частичный – у 29% пациентов, а радиотерапия без гендицина – только 19% и 60% соответственно.
Однако многие вирусные векторы способны вызвать иммунный ответ, приводящий к повреждению ткани и/или снижению количества комплексов ДНК с вирусной плазмидой за счет действия антител.
Также, как это стало понятно после масштабных исследований вакцины от АстраЗенека и Джонсон-и-Джонсон, с вирусными векторами на основе аденовируса связаны и редкие виды тромбоза.
Существуют и иные проблемы и сложности использования генной терапии, тормозящие ее массовое применение.
Одна из сложностей заключается в том, чтобы выявить и обеспечить соответствующий уровень генной коррекции, необходимый для каждого конкретного заболевания, что включает определение и необходимого количества копий, и количества интеграций для встраивания векторов, и количества клеток, которые должны быть преобразованы.
Также не менее важно определить уровень экспрессии терапевтического гена. Обычно он зависит от выбора сильного или слабого промотора (последовательность нуклеотидов ДНК, узнаваемая РНК-полимеразой как стартовая площадка для начала транскрипции), который определяет, какой уровень экспрессии будет достигнут – высокий или низкий.
Ученые принимают во внимание и наличие возможности инсерционного мутагенеза, то есть мутационного изменения генома вследствие вставок (insertion), в результате чего может происходить частичная или полная инактивация генов. В частности, известно, что векторы, которые встраиваются в геном, могут влиять на гены в области интеграции.
Немаловажно также подавить экспрессию генов, которая является важным фактором для интеграции векторов, развития иммунного ответа на вектор (который определяет выбор способа введения), типа и чистоты вектора и биораспределения вещества после его введения в организм. В этот же вопрос входит и возможность побочной экспрессии, хотя использование специфичных для тканей промоторов может помочь решить эту проблему2.
Какие бывают векторы?
В генной терапии векторы делятся на три основные категории:
1. Интегрирующие вирусные векторы (например, на основе гаммаретровируса и лентивируса) – они встраиваются (интегрируются) в геном клетки-мишени и таким образом реплицируются в дочерние клетки в результате митоза.
2. Неинтегрирующие вирусные векторы (например, аденовирусы и аденоассоциированный вирус, AAV) – они остаются эписомными, тем самым потенциально снижая онкогенез.
Аденоассоциированный вирус (AAV) относится к семейству парвовирусов, он один из самых широко используемых вирусов в генной терапии. Ранее из-за своей низкой патогенности он практически не вызывал никакого интереса у медиков. Однако при развитии отрасли генной терапии оказалось, что у него есть два качества, делающие его идеальным кандидатом на роль вектора:
а) Отсутствие патогенности.
AAV не оказывает патологического влияния на организм человека. Он также вызывает слабый иммунный ответ, который делает потенциальные патогенные эффекты незначительными.
б) Предсказуемость.
AAV намного лучше других вирусов предсказуем: он встраивается по специфическому сайту, а случайные встраивания происходят с ничтожной частотой, что позволяет вести с ним широкую лечебную и исследовательскую работу. Ретровирусы, например, могут вызывать рак из-за способности случайным образом встраиваться в геном.
3. Невирусные векторы – например, плазмидная ДНК.
Другими распространенными типами вирусных векторов являются альфавирусы и вирусы герпеса.
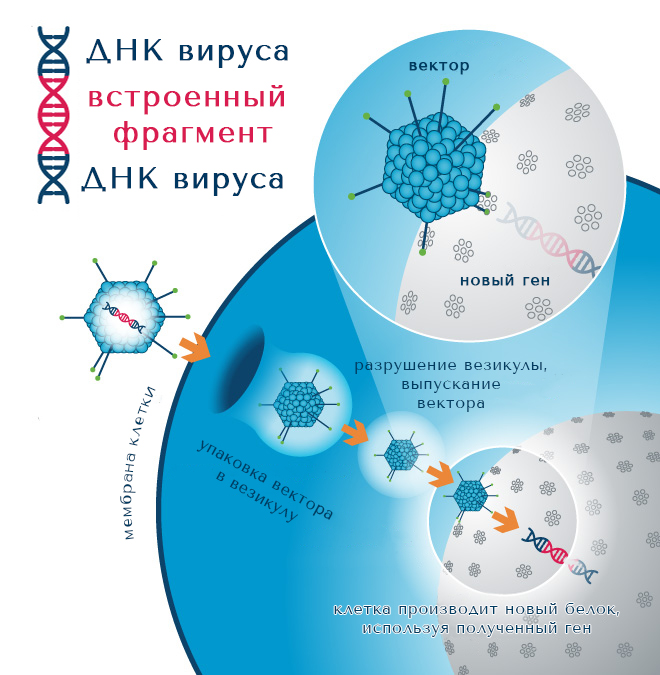
При выборе вирусного вектора перед учеными стоит вопрос – какой вектор нужен в данном конкретном случае: интегрирующий или неинтегрирующий. Если, например, целью является стволовая клетка-предшественник клеток крови, которая будет делиться и производить многочисленное потомство, лучшим выбором является интегрирующий вирусный вектор, потому что встроившийся ген будет передаваться в дочерние клетки. Однако если ткань состоит из неделящихся клеток, есть смысл использовать неинтегрирующий вектор.
Также ученые учитывают избирательность вирусного вектора, тип клеток-мишеней и потенциальные проблемы токсичности и генотоксичности. Основанием к последнему послужило исследование 2002 года, которое обнаружило, что у ряда пациентов, которым был проведен перенос генов с помощью интегрирующих векторов, из-за мутагенеза развилась лейкемия3. Часть ученых считает, что такой риск существует не только при использовании интегрирующих ретровирусов, но и с неинтегрирующими векторами, такими как AAV4.
Все тот же AAV, несмотря на многие его положительные качества, все же в нескольких клинических исследованиях продемонстрировал иммунотоксичность, что потенциально может помешать реализации лечебного воздействия препарата на его основе, хотя иммуногенность у этого вектора низкая и особых побочных эффектов за ним замечено до сих пор не было5 6.
Наконец, важно учитывать не только стабильность вирусного вектора в лабораторных условиях, но и в живом организме, а также определить наилучший способ его безопасного получения и очистки.
Как получают векторы
Вирусные векторы относятся к классу биологических препаратов и представляют собой продукт передовых биомедицинских исследований.
Существует три основных способа получения вирусных векторов: использование стабильной клеточной линии-производителя, использование переходной трансфекции, то есть введения нуклеиновой кислоты в клетки невирусным методом, и использование инфекции.
Использование стабильной линии-производителя подразумевает стабильно интегрированные гены Gag/Pol и env, необходимые для создания вирусной частицы. Но здесь отсутствует сама векторная последовательность, которая обычно вводится в виде вируса или плазмиды. Поскольку использование плазмиды является неэффективным методом получения вирусного вектора, способного к интеграции, то их обычно получают с использованием вируса.
Затем клетки выращивают, выбирают нужный клон, а после из этого клона создается так называемый главный, или маточный, банк клеток – культура клеток с подтвержденным отсутствием загрязнений, распределенная по емкостям в процессе одной операции таким образом, чтобы обеспечивались ее однородность и стабильность, и хранимая при температуре - 70 °С или ниже7.
После того, как клеткам позволят оттаять и поместят их в питательную среду, они начнут производить вирусный вектор.
После того, как произошел выбор вирусного вектора и последовательности генов, вносить изменения уже больше нельзя.
В отличие от использования стабильных линий-производителей, для переходной трансфекции требуется всего три дня, причем все векторы производятся из одного главного банка клеток. Этот процесс не только быстр – при нем вектор можно изменять вплоть до момента получения.
Но при использовании трансфекции растет загрязненность плазмидами, которые необходимо удалить при производстве и очистке. Также само производство более сложное и труднее, чем производство с использованием стабильной линии-производителя, масштабируется. И если процесс не будет хорошо контролироваться, возможен разброс от партии к партии.
Как контролируется производство?
Практика GMP определяет жесткие требования к производству и разработке векторов на всех этапах. Так, для клеточного субстрата, используемого для производства биологического препарата, следует предоставить первичную документацию, в которой описывается общая информация по клеточному субстрату, а также общая информация по каждой родительской клеточной линии, из которой клеточный субстрат был выделен полностью или частично. Все производимые с клеточным субстратом манипуляции требуется подробно документировать на протяжении всего процесса разработки. Описание истории клетки является одним из множества инструментов, используемых при установлении характеристики клеточного субстрата8.
Для клеточных линий человека требуется описание следующих характеристик исходного донора: происхождение ткани или органа, этническое и географическое происхождение, возраст, пол и общее физиологическое состояние. При использовании линии животных клеток в описании источника необходимо указать виды, линии, условия разведения, происхождение ткани или органа, географическое происхождение, возраст, пол, а также результаты тестирования на наличие патогенных агентов и общее физиологическое состояние первичного донора. При использовании микроорганизмов производители должны указать их вид, штамм и известные генотипические и фенотипические характеристики организма, из которого был выделен клеточный субстрат. Производители также должны привести данные по патогенности, образованию токсинов и прочую информацию о биологической опасности, если таковая имеет место.
Должна быть документально оформлена и история культивирования клеток. Наряду с методиками культивирования клеток in vitro и любыми методами создания клеточных линий (например, использование физических, химических, биологических методов или введение нуклеотидных последовательностей), необходимо описать подход, первоначально использованный для выделения клеток. Необходимо описать все имевшие место генетические манипуляции или генетический отбор (селекцию). Также должна быть предоставлена и вся доступная информация, относящаяся к идентификации, характеристикам этих клеток и результатам их тестирования на наличие эндогенных или посторонних агентов.
В отношении получения клеточного субстрата заявители должны провести тщательный анализ процессов, при использовании которых возможен занос инфекционных агентов. Должно быть представлено описание компонентов культуральной среды, особенно информация, касающаяся воздействия на клетки компонентов человеческого и животного происхождения, таких как сыворотка, ферменты, гидролизаты или другие живые клетки. Описание должно включать источник, метод приготовления и контроля, результаты испытаний и обеспечение качества.
Как можно понять из всего вышеизложенного, разработка и производство векторов – это не просто задачка «ослабил безобидный вирус и прикрутил к нему необходимый белок», а скрупулезно контролируемый на всех этапах процесс. Наукоемкость делает геннотерапию передовой областью медицины, а новизна и незнакомость деталей заставляет разворачивать тщательно спланированные, масштабные исследования перед допуском каждого препарата подобного рода на мировой рынок – даже в условиях пандемии, которая подстегивает разработчиков и производителей. Недаром статистика по вакцинам собирается сейчас с миллионных когорт, и недаром только на миллионных когортах виден тот или иной побочный эффект.
Так что же со Спутником?
В случае же со Спутником V, помимо плохо спланированных клинических исследований, не позволяющих в полной мере оценить эффективность и безопасность вакцины (это поправимая проблема – достаточно повторно провести испытания по всем правилам и учесть как побочные эффекты, так и реальную пользу от вакцины), не предоставленной оказалась и информация о происхождении клеточного субстрата, на котором выращивался вектор.
Проблема упирается еще и в то, что в качестве культуры выбрана эмбриональная телячья сыворотка, которая, после вспышки коровьего бешенства в 1980-х годах, требует особого документального подтверждения ее происхождения из безопасного источника, а российский фармрегулятор и Национальный исследовательский центр эпидемиологии и микробиологии имени Н. Ф. Гамалеи до сих пор не торопятся доказать ее безопасность. Если же информация не будет предоставлена, Институту для продвижения своей вакцины на Запад придется создавать новый вектор и проводить новые клинические испытания, то есть фактически разрабатывать препарат с нуля9.
Примечания
- 1. Gene Therapy Market, 2015 – 2025
- 2. Разработка и получение вирусных векторов: будущее генной терапии
- 3. Efficacy of gene therapy for X-linked severe combined immunodeficiency
- 4. A largely random AAV integration profile after LPLD gene therapy
- 5. Humoral immunity to AAV vectors in gene therapy: challenges and potential solutions
- 6. Immune responses to AAV vectors: overcoming barriers to successful gene therapy
- 7. Главный банк клеток (master cell bank)
- 8. Выделение и характеристика клеточных субстратов, используемых при производстве биотехнологических/биологических препаратов
- 9. European efforts to assess Russia’s Sputnik V vaccine stymied by data gaps