Хелатное железо – мода или необходимость?

«Хелатный» – в последнее время часто видим мы на этикетках БАДов и официнальных лекарственных средств перед названием того или иного микроэлемента. Что это значит? Почему так активно продвигается медицинской рекламой и действительно ли настолько нужно нам?
История хелатов
Хелатирование – процесс, который химики знают более столетия. Еще в девяностых годах девятнадцатого века ученые признавали, что некоторые атомы могут иметь более одного валентного состояния. Однако до тех пор, пока не была предложена теория хелатирования, не было понятно, как именно эти конкретные атомы могут образовывать высокостабильные соединения.
В 1893 году Альфред Вернер предложил новую молекулярную структуру для описания этих стабильных молекул. Он заметил, что определенные структурные единицы, которые он назвал «комплексами», остались нетронутыми в результате ряда химических превращений. Вернер пришел к выводу, что: «Если рассматривать ион металла как центр всей системы, то проще всего разместить связанные с ним молекулы по углам октаэдра».
Приблизительно это можно выразить вот так.
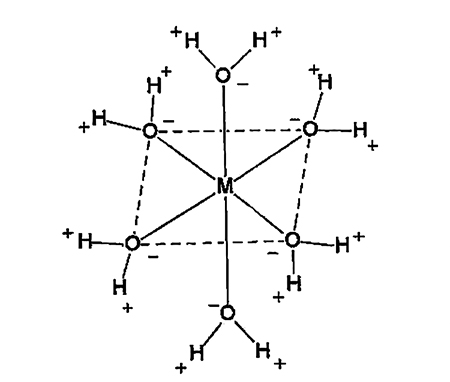
Растворимый ион металла (М) в гидрато-комплексе связан с рядом молекул воды, при этом отрицательный кислород водного диполя ориентирован к положительному металлу, что обеспечивает характерную фигуру.
Позже Вернер усовершенствовал свою концепцию, придя к выводу, что катион характеризуется двумя валентностями. Первую из них он назвал «главной валентностью», что, по нынешней терминологии, соответствует понятию степени окисления металла. Вторая валентность получила название «вспомогательной валентности», что сейчас отвечает термину «координационное число металла», т.е. число ближайших «соседей», связанных с центральным ионом металла.
В 1913 году Вернер получил за свое открытие Нобелевскую премию.
Сам же термин «хелат» возник в 1920 году, когда Морган и Дрю применили его к молекулярной структуре, постулированной Вернером. Было признано, что для образования хелата лиганд должен иметь минимум две точки присоединения к иону металла. Именно этот способ прикрепления, напоминающий штангенциркуль, привел к использованию греческого слова «chele», означающего клешню омара, для описания того, как лиганд прикрепляется к иону металла. Когда такая «клешня» удерживала катион, способность металла вступать в другие химические реакции ограничивалась.
Химические и физические характеристики металла после хелатирования изменяются. В солях металла катион связан электростатическим притяжением, а хелаты – это так называемые координационные (или комплексные) соединения. Для образования гетероциклического кольца с металлом, являющимся частью этого кольца, лиганд должен мочь отдать более одного атома. В хелате лиганд отдает электроны катиону1.
Понимание структуры и характеристик хелатов металлов имело далеко идущие последствия в медицине, биологии, химии, химии окружающей среды и, в частности, в области питания из-за стабильности образованной металлической молекулы. Мы рассмотрим их на примере самого, наверное, известного из «медицинских хелатов» – хелатного железа.
Эволюция препаратов железа
Говоря о хелатном железе, нельзя не сказать об эволюции препаратов железа вообще – ведь именно после понимания всей длины этой эволюции и всех сложностей усваивания железа человеческим организмом становится понятно место хелатов в группе этих лекарственных средств.
Традиционно лекарственные средства для лечения анемии делились на двух- и трехвалентные. Это было обусловлено тем, что всасывание железа в кишечнике полноценно возможно лишь тогда, когда микроэлемент находится в растворимой, двухвалентной форме ферро-иона (Fe2+), которая способна проходить через клеточную мембрану слизистой оболочки кишечника. Ферри-ион (Fe3+) же образует нерастворимые соли. Низкое значение кислотности желудочного сока способствует растворению железа, поступающего с пищей, и переходу трехвалентного железа (окисное) в двухвалентную форму (закисное).
Неудивительно, что врачи первым делом попытались применить для лечения ионные соли двухвалентного железа, типа сульфата железа. Эта группа считается первым поколением противоанемических препаратов и характеризуется довольно быстрым достижением эффекта в плане повышения уровня гемоглобина.
Тем не менее, лечение ионными (солевыми) препаратами железа вызывает побочные реакции едав ли не у половины пациентов. Чаще всего они представлены поражением желудочно-кишечного тракта: от тошноты или дискомфорта в животе до боли и рвоты.
Причиной возникновения этих побочных явлений является гидролиз солей железа в желудке. Под действием желудочного сока ионные соли железа подвергаются гидролизу (диссоциации) в желудке, в результате чего свободные молекулы железа негативно воздействуют на слизистую оболочку ЖКТ и провоцируют возникновение побочных эффектов: тошнота, боль в животе, металлический привкус во рту, понос или запор.
Кроме того, сульфат железа и его «родственники» обеспечивают потемнение эмали и десен, а также чрезвычайно чувствительны к режиму приема. Так, они широко взаимодействуют в просвете кишечника с едой и лекарствами, мешая всасываться себе и другим. Из-за этого обычно их назначают за час до приема пищи, однако это усиливает повреждающее действие соединений двухвалентного железа на слизистую кишечника.
Второе поколение препаратов железа представлено гидроксид-полимальтозным комплексом железа-3. Его абсорбция осуществляется путем активного всасывания при конкурентном обмене лигандами, уровень которых определяет скорость абсорбции железа Fe3+. Неионная структура, обеспечивающая стабильность комплекса и перенос железа с помощью транспортного белка, предотвращает в организме свободную диффузию ионов железа, то есть прооксидантные реакции.
Однако ГПК не стал самой распространенной формой препаратов железа. Этому помешал один-единственный факт – биодоступность, то есть процент абсорбированного и употребленного железа у такой формы, его биохимический КПД, самая низкая в группе и составляет всего 10–15%. Огромные размеры молекулы приводят к тому, что ее пассивная диффузия примерно в 40 раз медленнее, чем у ионов железа.
Глицинат на бис
Хелатное железо «зовут» бисглицинатом. Оно состоит из одной молекулы железа, соединенной с карбоксильными группами двух молекул аминокислоты глицина при помощи ковалентных связей.
Две молекулы глицина прочно связывают две валентности железа, делая тем самым молекулу ионно-нейтральной, устойчивой к разным факторам, действующим в желудочно-кишечном тракте (рН, пища), а низкая молекулярная масса способствует максимальному усвоению железа при пероральном приеме. Кроме того, небольшие белковые молекулы легче усваиваются, поэтому наш организм объединяет неорганические минералы с аминокислотами, чтобы воспользоваться сродством кишечника к всасыванию белка.
Благодаря этому хелат бисглицинат железа транзитом проходит через желудок и всасывается слизистой оболочкой тонкой кишки в неизмененном виде. И только после всасывания под воздействием цитоплазматических ферментов клеток кишечника происходит отщепление глицина, высвобождение свободного железа и поступление его в кровь.
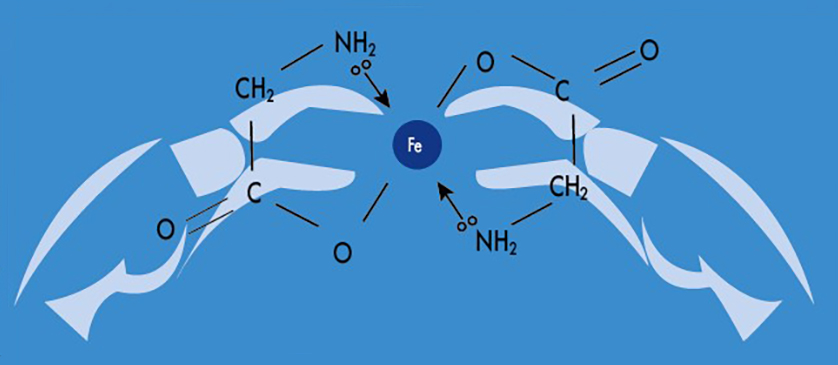
Таким образом, контакт свободного железа со слизистой оболочкой желудочно-кишечного тракта тракта отсутствует, поэтому бисглицинат железа характеризуется очень хорошей переносимостью2.
Не вступает в контакт хелатное железо и со всеми продуктами, которые ограничивают эффективность солевых его форм – молочными продуктами, чаем, кофе и т.д. Благодаря этому, его можно применять независимо от приема пищи, что значительно увеличивает приверженность пациентов терапии. Не мешает хелатное железо и всасыванию других веществ, в частности лекарственных препаратов.
Еще одним важным преимуществом бисглицината железа является его очень высокая биодоступность – практически в 4 раза больше, чем у сульфата железа,– что обуславливается наличием двух путей абсорбции. Хелатное железо связывается как с рецепторами, предназначенными для солей железа, DMT-1, которые находятся на ворсинках двенадцатиперстной кишки, так и с рецепторами для связывания пептидов PEPT‑1, которые соединяются с глицином и находятся на протяжении всего ЖКТ.
Этот факт обеспечивает, например, эффективность бисглицината железа у пациентов с целиакией, которые не могут принимать солевые формы железа.
Благодаря всем перечисленным выше особенностям, биодоступность бисглицината железа приближается к 90–100%, но, несмотря на такую высокую биодоступность, эта форма железа продолжает оставаться самой безопасной3.
Так, уровень отсутствия наблюдаемых побочных эффектов(NOAEL) составляет не менее 500 мг на кг веса.
Недостатки хелатного железа
Однако результаты клинических исследований не так оптимистичны относительно биодоступности и повышенной результативности хелатных форм железа.
Так, исследование с участием беременных женщин с дефицитом железа, опубликованное в «Журнале перинатальной медицины», показало, что не было никакой разницы по восполнению железодефицита в группе принимавших солевые формы (сульфат железа) и хелатные (бисглицинат).
Еще одно исследование 2014 года показало, что прием 30 миллиграммов хелатного железа в течение 90 дней был так же эффективен, как и сульфат железа, для поддержания нормального уровня железа у детей школьного возраста с низким уровнем железа (без анемии).
Кроме того, хоть и хелатное, железо также продолжает оставаться токсичным в больших дозах.
Так, например, случайная передозировка препаратами железа до сих пор является основной причиной смертельных отравлений у детей в США. Отчасти это может быть связано с тем, что об опасности приема слишком большого количества железа мало кто знает.
Также не рекомендуется (за исключением особых случаев) принимать хелатное железо, если у человека имеется «перегрузка» железом (например, гемохроматоз или гемосидероз), алкогольная зависимость, заболевания печени, а также проблемы с ЖКТ типа язвенного колита, синдрома раздраженной кишки или язвенных поражений.
Как лучше принимать хелатное железо
Общие рекомендации по дозировке хелатного железа предполагают, что средняя доза железа для взрослого человека с дефицитом железа составляет от 60 до 120 мг в день в течение как минимум 90 дней.
- Лучше принимать хелатное железо натощак, если у вас оно не раздражает желудок, и избегать приема антацидов, молочных продуктов или напитков с кофеином в течение двух часов (до и после) приема хелатного железа.
- Запивать хелатное железо лучше стаканом простой воды.
- После приема железа желательно не лежать.
- Нельзя принимать слишком много железа – даже в хелатной форме оно сохраняет токсичность и может привести к серьезным проблемам со здоровьем.
- На биодоступность хелатного железа оказывает влияние ряд факторов. Например, витамин С увеличивает скорость усвоения, поэтому многие добавки железа также содержат витамин С.
- Также многие добавки хелатного железа содержат и витамины группы В, также способствующие лучшему КПД железа.
И последнее: так как железо, чтобы правильно усваиваться организмом, должно быть в двухвалентной форме, покупая БАД, убедитесь, что добавка содержит именно бисглицинат двухвалентного железа.




